植物分子細胞生物学・年報(2021年度)
研究内容の概略
本研究室では、植物が示す驚異的な環境適応能力の分子基盤として、環境刺激に応答したゲノム規模の遺伝子発現制御、およびその結果もたらされるプロテオームの多様化やオルガネラの機能分化、また細胞・組織・器官間で行われる長距離シグナル伝達などの過程に着目し、それらの現象を遺伝子、タンパク質および細胞レベルで研究しています。その際、ゲノム科学、分子遺伝学、分子生物学、生化学、細胞生物学、植物生理学などの手法を複合的に駆使し、多面的なアプローチによって研究を展開しています。
1. 転写開始点選択の仕組みと遺伝子機能の多面性
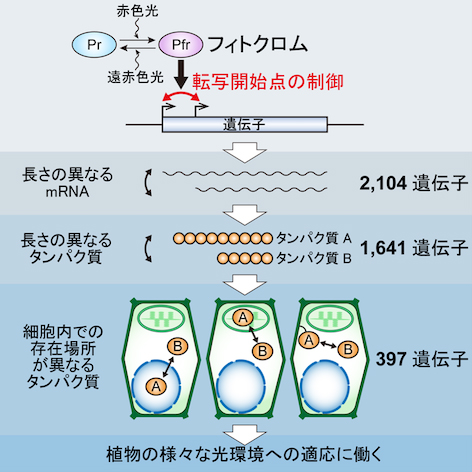
生物の複雑さはプロテオームの多様さに依存しますが、ある1つの生物種が持つ遺伝子の数には限りがあります。そこで、より高度な生命活動を営むためには、機能の異なる複数のタンパク質を1つの遺伝子から生み出す仕組みが必要となります。
転写開始点選択とは、1つの遺伝子内に存在する複数の転写開始点から、長さの異なるmRNA分子が転写される現象のことであり、選択的スプライシングと並んで、プロテオームの拡大に貢献しうる機構として知られています。しかしながらこれまで、プロテオームに対するインパクトは小さいと考えられていたため、その重要性は軽んじられてきました。
私たちは最近、植物の主要な光受容体であるフィトクロムが、シロイヌナズナにおいて2,000を超える遺伝子に直接働きかけそれらの転写開始点を変化させること、これに伴い約400のタンパク質の細胞内局在が光によって変化すること、そしてそれらタンパク質の細胞内局在変化が植物の様々な光環境への適応に寄与することを発見しました(Ushijima et al., Cell 2017)(図1)。
これらの発見は、転写開始点選択という現象が、転写・スプライシング・翻訳と並び、真核生物のセントラルドグマにおける新たな普遍的一過程として、プロテオームの機能的な多様化に少なからず寄与することを強く示すものであります。そして同規模の転写開始点変化は、フィトクロムシグナルに限らず、ありとあらゆるシグナルにより、真核生物において共通の分子機構で引き起こされるものである可能性が高いと考えられます。
そこで私たちは、モデル植物であるシロイヌナズナを用いて、フィトクロムによる転写開始点制御をモデルケースとしてその分子機構を解明することで、真核生物に普遍的な新規遺伝子発現制御機構を明らかにし、セントラルドグマに新たな一過程を付け加えることを目指します。その結果として近い将来、生物の教科書の書きかえが行われるものと期待されます。
また、様々な環境刺激に応じて転写開始点が変化することで、同じ1つの遺伝子から、これまで知られていた機能とは全く異なる機能を持ったタンパク質が生じるケースが、次々と明らかになってきました。そこで今後私たちは、さらに多くの遺伝子について、転写開始点の切り替えによって発揮される遺伝子機能の多面性を明らかにし、多くの遺伝子が持つ「裏の顔」を暴くことで、プロテオームの未開領域の開拓を進めます。
2. 葉の気孔ができるしくみの解明
植物は大気中から二酸化炭素(CO2)を吸い込み、そのCO2を基にして私達の大切な食糧となるデンプンや油を作ります。植物がCO2を吸い込むときに使う「口」に相当するのが気孔で、まさに唇のような形をしています。私達はモデル植物シロイヌナズナを用いて、この気孔がどのようなメカニズムで形成されているのかを調べています。
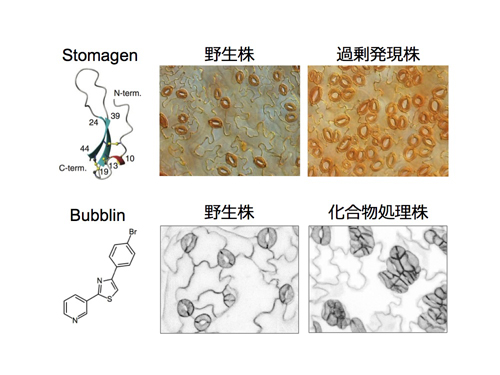
私達は気孔の数を調節する機能をもつ新しい生理活性ペプチド「Stomagen」を発見しました(図2上)。Stomagenは45個のアミノ酸からなる小さなペプチドで、雑草から作物や樹木に至る多種多様な植物がもっている普遍的な因子です。Stomagenを植物に与えると気孔の数が増えることから、様々な植物のCO2吸収能力を上げる応用研究への発展が期待されます。
さらに私達は最近、気孔形成に影響を与える新規化合物Bubblinを発見しました(図2下)。3,650種の低分子化合物からなるケミカルライブラリーをスクリーニングした結果、ピリジン-チアゾール化合物の一種が気孔の分布や形成パターンに影響を与えることを見出しました。私達はこの化合物をBubblinと名付け解析を行いました。
植物体にBubblinを処理すると、互いに隣接した気孔が多数形成されます。詳しい解析の結果、Bubblinは気孔前駆細胞の極性形成に影響しており、非対称分裂に異常を示すことが判明しました。植物細胞における極性形成メカニズムは未解明な部分も多く、今後Bubblinの解析によって気孔前駆細胞をモデルとした植物の細胞極性の形成をつかさどるメカニズムの解明につながることが期待されます。
最近の主な発表論文
- Yagi H, Tamura K, Matsushita T, Shimada T. (2021) Spatiotemporal relationship between auxin dynamics and hydathode development in Arabidopsis leaf teeth. Plant Signal. Behav. 16, 1989216.
- Yagi H, Nagano AJ, Kim J, Tamura K, Mochizuki N, Nagatani A, Matsushita T, Shimada T. (2021) Fluorescent protein-based imaging and tissue-specific RNA-seq analysis of Arabidopsis hydathodes. J Exp. Bot. 72, 1260-1270.
- Sakoda K, Yamori W, Shimada T, Sugano SS, Hara-Nishimura I, Tanaka Y. (2021) Higher Stomatal Density Improves Photosynthetic Induction and Biomass Production in Arabidopsis Under Fluctuating Light. Front Plant Sci. 11, 589603.
- Izuishi Y, Isaka N, Li H, Nakanishi K, Kageyama J, Ishikawa K, Shimada T, Masuta C, Yoshikawa N, Kusano H, Yazaki K. (2020) Apple latent spherical virus (ALSV)-induced gene silencing in a medicinal plant, Lithospermum erythrorhizon. Scientific Rep. 10, 13555.
- Takagi T, Kimori Y, Shimada T, Hara-Nishimura I. (2020) Fluorescent protein-based imaging and tissue-specific RNA-seq analysis of Arabidopsis hydathodes. iScience 23, 101265.
- Ichino T, Maeda K, Hara-Nishimura I, Shimada T. (2020) Arabidopsis ECHIDNA protein is involved in seed coloration, protein trafficking to vacuoles, and vacuolar biogenesis. J Exp. Bot. 71, 3999-4009.
- Ishikawa K, Tamura K, Fukao Y, Shimada T. (2019) Structural and functional relationships between plasmodesmata and plant endoplasmic reticulum-plasma membrane contact sites consisting of three synaptotagmins. New Phytologist. 226, 798-808.
- Sakaguchi J, Matsushita T, and Watanabe Y. (2019) DWARF4 accumulation in root tips is enhanced via blue light perception by cryptochromes. Plant Cell Environ. 42, 1615-1629.
- Nakazaki A, Yamada K, Kunieda T, Tamura K, Hara-Nishimura I, Shimada T. (2019) Biogenesis of leaf endoplasmic reticulum body is regulated by both jasmonate-dependent and independent pathways. Plant Signal. Behav. 14, 1622982.
- Shimada TL, Shimada T, Okazaki Y, Higashi Y, Saito K, Kuwata K, Oyama K, Kato M, Ueda H, Nakano A, Ueda T, Takano Y, Hara-Nishimura I. (2019) HIGH STEROL ESTER 1 is a key factor in plant sterol homeostasis. Nature Plants 5, 1154-1166.
- Maeda K, Kunieda T, Tamura K, Hatano K, Hara-Nishimura I, Shimada T. (2019) Identification of periplasmic root-cap mucilage in developing columella cells of Arabidopsis thaliana. Plant Cell Physiol. 60, 1296-1303.
- Yoshinari A, Hosokawa T, Amano T, Beier MP, Kunieda T, Shimada T, Hara-Nishimura I, Naito S, Takano J. (2019) Polar Localization of the Borate Exporter BOR1 Requires AP2-Dependent Endocytosis. Plant Physiol. 179, 1569-1580
- Nakazaki A, Yamada K, Kunieda T, Sugiyama R, Hirai MY, Tamura K, Hara-Nishimura I, Shimada T. (2019) Leaf endoplasmic reticulum bodies identified in Arabidopsis rosette leaves are involved in defense against herbivory. Plant Physiol. 179, 1515-1524.
- Ishikawa K, Tamura K, Shimada T. (2018) Subcellular localisation of an endoplasmic reticulum-plasma membrane tethering factor, SYNAPTOTAGMIN 1, is affected by fluorescent protein fusion. Plant Signal. Behav. 13, e1547577.
- Sugano SS, Nishihama R, Shirakawa M, Takagi J, Matsuda Y, Ishida S, Shimada T, Hara-Nishimura I, Osakabe K, Kohchi T. (2018) Efficient CRISPR/Cas9-based genome editing and its application to conditional genetic analysis in Marchantia polymorpha. PLoS One 13, e0205117.
- Ishikawa K, Tamura K, Ueda H, Ito Y, Nakano A, Hara-Nishimura I, Shimada T. (2018) Synaptotagmin-Associated Endoplasmic Reticulum-Plasma Membrane Contact Sites Are Localized to Immobile ER Tubules. Plant Physiol. 178, 641-653.
- Shimada T, Kunieda T, Sumi S, Koumoto Y, Tamura K, Hatano K, Ueda H, Hara-Nishimura I. (2018) The AP-1 Complex is Required for Proper Mucilage Formation in Arabidopsis Seeds. Plant Cell Physiol. 59, 2331-2338.
- Ueda H, Ohta N, Kimori Y, Uchida T, Shimada T, Tamura K, Hara-Nishimura I. (2018) Endoplasmic Reticulum (ER) Membrane Proteins (LUNAPARKs) are Required for Proper Configuration of the Cortical ER Network in Plant Cells. Plant Cell Physiol. 59, 1931-1941.
- Shimada T, Fuji K, Ichino T, Teh OK, Koumoto Y, Hara-Nishimura I. (2018) GREEN FLUORESCENT SEED, to Evaluate Vacuolar Trafficking in Arabidopsis Seeds. Methods Mol Biol., 1789, 1-7.
- Shimada T, Takagi J, Ichino T, Shirakawa M, Hara-Nishimura I. (2018) Plant Vacuoles. Annu Rev Plant Biol. 69, 123-145.
- Hatsugai N, Nakatsuji A, Unten O, Ogasawara K, Kondo M, Nishimura M, Shimada T, Katagiri F, Hara-Nishimura I. (2018) Involvement of Adapter Protein Complex 4 in Hypersensitive Cell Death Induced by Avirulent Bacteria. Plant Physiol. 176, 1824-1834.
- Ushijima T, Hanada K, Gotoh E, Yamori W, Kodama Y, Tanaka H, Kusano M, Fukushima A, Tokizawa M, Yamamoto YY, Tada Y, Suzuki Y, Matsushita T. (2017) Light controls protein localization through phytochrome-mediated alternative promoter selection. Cell 171, 1316-1325.
- Wang S, Yoshinari A, Shimada T, Hara-Nishimura I, Mitani-Ueno N, Ma JF, Naito S, Takano J. (2017) Polar Localization of the NIP5;1 Boric Acid Channel Is Maintained by Endocytosis and Facilitates Boron Transport in Arabidopsis Roots. Plant Cell 29, 824-842.
- Sakai Y, Sugano SS, Kawase T, Shirakawa M, Imai Y, Kawamoto Y, Sugiyama H, Nakagawa T, Hara-Nishimura I, Shimada T. (2017) The chemical compound bubblin induces stomatal mispatterning in Arabidopsis by disrupting the intrinsic polarity of stomatal lineage cells. Development 144, 499-506.
- Shimada T, Hara-Nishimura I. (2017) Isolation of Protein Storage Vacuoles and Their Membranes. Methods Mol Biol. 1511, 163-168.
- Shirakawa M, Ueda H, Shimada T, Hara-Nishimura I. (2016) FAMA: A Molecular Link between Stomata and Myrosin Cells. Trends Plant Sci. 21, 861-871.
- Ueda H, Yokota E, Kuwata K, Kutsuna N, Mano S, Shimada T, Tamura K, Stefano G, Fukao Y, Brandizzi F, Shimmen T, Nishimura M, Hara-Nishimura I. (2016) Phosphorylation of the c terminus of rhd3 has a critical role in homotypic er membrane fusion in Arabidopsis. Plant Physiol. 170, 867-880.
- Fuji K, Shirakawa M, Shimono Y, Kunieda T, Fukao Y, Koumoto Y, Takahashi H, Hara-Nishimura I, Shimada T. (2016) The adaptor complex AP-4 regulates vacuolar protein sorting at the trans-golgi network by interacting with VACUOLAR SORTING RECEPTOR1. Plant Physiol. 170, 211-219.
- Wang Q, Zuo Z, Wang X, Gu L, Yoshizumi T, Yang Z, Yang L, Liu Q, Liu W, Han Y, Kim J, Liu B, Wohlschlegel JA, Matsui M, Oka Y, Lin C. (2016) Photoactivation and inactivation of Arabidopsis cryptochrome 2. Science 354, 343-347.
- Shikata H, Hanada K, Ushijima T, Nakashima M, Suzuki Y, Matsushita T. (2014) Phytochrome controls alternative splicing to mediate light responses in Arabidopsis. Proc Natl Acad Sci USA. 111, 18781-18786.
- Sugano SS, Shimada T, Imai Y, Okawa K, Tamai A, Mori M, Hara-Nishimura I. (2010) Stomagen positively regulates stomatal density in Arabidopsis. Nature 463, 241-244.
2021 年度学位論文
修士論文
- 寺西 岳生「ゼニゴケ胞子体に発現するCCCH型ジンクフィンガータンパク質の機能解析」
メンバー
- 松下 智直(教授)
- 嶋田 知生(講師)
- 岡 義人(助教)
- 得津 隆太郎(博士研究員)
- 大西 美輪(博士研究員)
- 木村 泉美(教務補佐員)
- 河本 恭子(教務補佐員)
- 竹中 佐知(技術補佐員)
- 尾﨑 昭子(技術補佐員)
- 吉村 恵実(事務補佐員)
- 小林 遼亮(博士後期課程3年)
- 細川 智佳(博士後期課程3年)
- 守屋 健太(博士後期課程3年)
- 村上 知暉(博士後期課程2年)
- 河原 直也(修士課程2年)
- 三星 亮太朗(修士課程2生)
- 伊東 杏花里(修士課程1生)
- 島 孝元(修士課程1生)
- 杉本 佐和(修士課程1生)
- 豊田 隆藏(修士課程1生)
- 村上 吉朗(修士課程1生)