植物生理学分科・年報(2024 年度)
研究内容の概略
本研究室では、植物が自然界で環境に適応するために進化させた、頑健かつ柔軟な生存戦略を明らかにすることを目指しています。具体的には、植物が局所的な環境シグナルを感知し、その情報をどのように細胞内で伝達するのか、さらにはその情報がどのように組織や個体全体に伝わり、最終的な生理応答を引き起こすのかを研究しています。最新のイメージング技術や、独自に開発したマイクロデバイス、遺伝子発現ネットワーク解析手法などを活用し、分子・細胞・組織・個体レベルに及ぶ多層的なアプローチにより、植物が進化の過程で獲得してきた複雑で巧妙な生物システムの全貌を解明します。
1. 接木の含む生物機構の研究
植物が全身性シグナル伝達機構をどのように発揮するのかを解明するため、私たちは2つ以上の植物を1つにつなぐ「接木」という技術を実験のツールとして活用してきました。一方で、接木そのものが引き起こす生物現象に着目し、そのメカニズムに迫る研究も行っています。
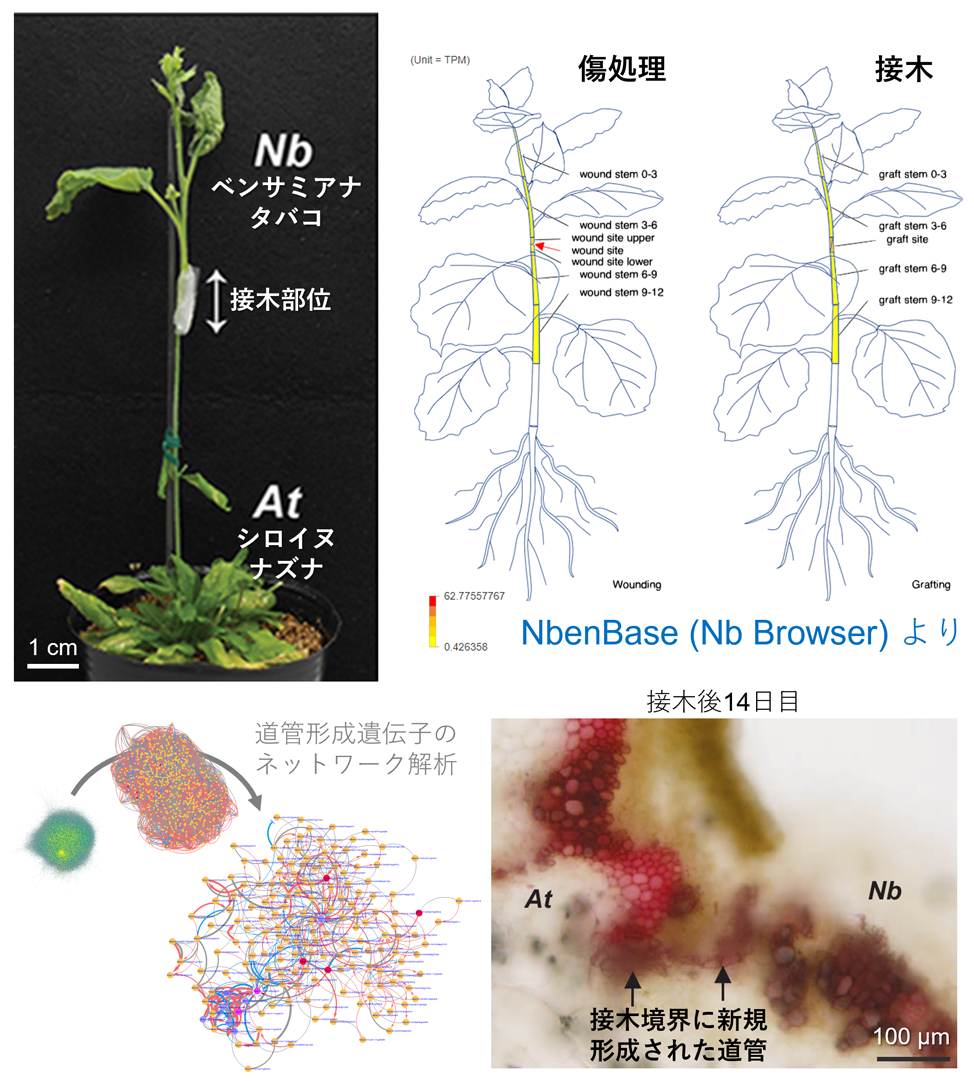
接木は、2つ以上の植物をつなぐことでそれぞれの持つ有用な性質を兼ね備えた植物を作出する方法であり、果樹や野菜などを中心に古くから農業利用されてきました。これまで接木は、近縁な植物間でしか成立せず、科が異なる遠縁な植物間では不可能であると考えられてきました。私たちはタバコ属植物をはじめとするいくつかの植物種では、遠縁な植物の接木(異科接木)が可能であるということを世界で初めて発見しました(Science, 2020; Plant Cell Physiol., 2021; 図1左上)。また、ベンサミアナタバコ(Nicotiana benthamiana)の全ゲノム配列を明らかにし(Plant Cell Physiol., 2023)、様々な生育ステージや接木を含む部位ごとの遺伝子発現プロファイルをグラフィカルに閲覧可能なブラウザを構築しました(Plant J., 2024; 図1右上)。さらに、ゲノムデータを中心としてデータベースと解析ツール群を連携して使用できる環境をウェブサービスとして提供しています(https://nbenthamiana.jp)。
接木において発現が変動する遺伝子に着目することで、植物が傷を修復するときや寄生植物が宿主植物に寄生するときにも、接木と共通の分子機構が発動していることを見出しています。これらの現象に共通するイベントのひとつに自他認識がありますが、接木の細胞生物学的・遺伝学的な解析を通じて、接木境界部位におけるオートファジーの活性化や、活性酸素種の産生抑制に関与する未知の遺伝子の存在を発見しました。このように、接木という視点から、植物の自他認識に対する理解を深めることを目指しています。
切断面の細胞同士の接着と並行して、上下の植物間には維管束組織の再構築が観察されます。私たちは、遺伝子ネットワーク解析によって、異科接木においても明確に観察される道管の新規形成に寄与する遺伝子群を同定しました(Hortic. Res., 2023; 図1下)。さらに、分子遺伝学的解析、バイオインフォマティクス、そして最先端のイメージング技術を駆使して、植物の接木が成立する仕組みの全貌を解明しようとしています。
2. 植物の全身性シグナル伝達機構と適応戦略の研究
多細胞生物は、個々に機能分化した異なる器官や組織が協調して働くことで、個体レベルでの機能を最大限に発揮していると考えられます。固着生活を送る植物は、生態系における多様な生物・非生物的なストレスのもとで個体の適応性を高めるために、局所的に受容した環境情報に応じて局所的に応答するとともに、全身的に情報を伝えるためのシステム(全身性シグナル伝達機構)を獲得してきました(図2左)。
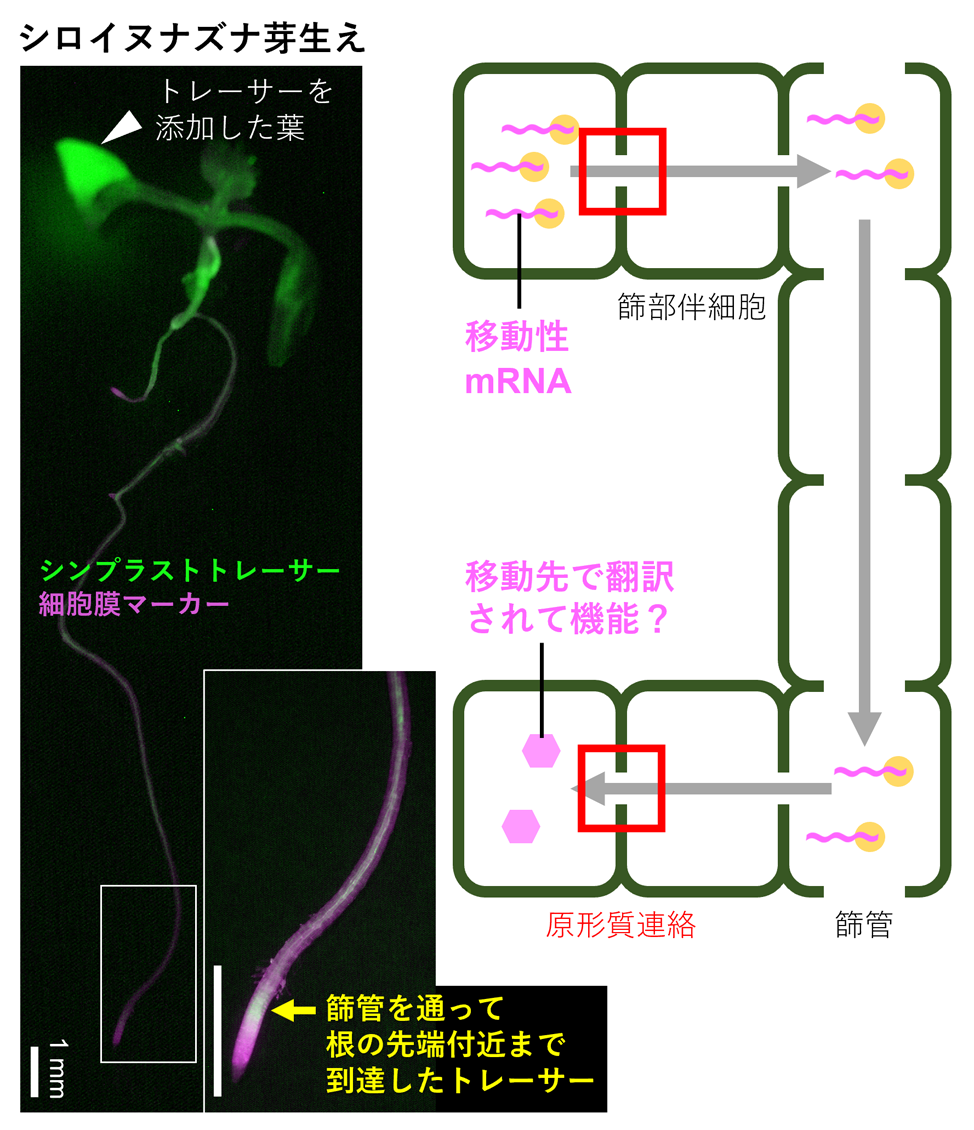
植物の全身性シグナル伝達は、篩管や道管といった維管束組織を介した植物ホルモン、small RNA、ペプチド、タンパク質などの分子輸送によって実現されます。例えば、花成や栄養飢餓応答、乾燥ストレス応答といった生理現象は、これらの分子移行を介して全身的に制御されていることが明らかになりつつあります。とくに陸上で繁殖圏を拡大した植物において、mRNAもまた移行性の分子として機能しており、その種類は他の移行分子に比べて圧倒的に多いことを私たちは明らかにしました。しかし、mRNAが輸送される生物学的な意義は依然として不明であり、その分子機構と生理機能を明らかにしたいと考えています。まず、異科接木の技術とバイオインフォマティクスを駆使して、輸送されるmRNAを網羅的に同定しました。現在、mRNAの長距離輸送の基本原理を明らかにしながら、個別の移動性mRNAの変異体の表現型を解析することで、mRNAが輸送されることで果たされる生理機能を探求しています(図2右)。このように私たちは、変動する環境下で植物がどのように発生・成長を全身的に制御し、適応しているのか、進化的な視点を交えて理解することを目指しています。
3. シンプラスト輸送を担う原形質連絡の研究
植物の隣接する細胞どうしは、細胞壁を貫通して2つの細胞質を直接連絡する「原形質連絡(プラズモデスマータ)」と呼ばれるトンネル構造でつながっており、この構造を通じて様々な物質が細胞間で輸送されています。この仕組みはシンプラスト輸送と呼ばれ、移動性mRNAもこの経路を介して全身的に移行すると考えられています。多細胞植物では、シンプラスト輸送の制御システムが、細胞や組織、さらには器官間での機能調節に重要であると考えられます。
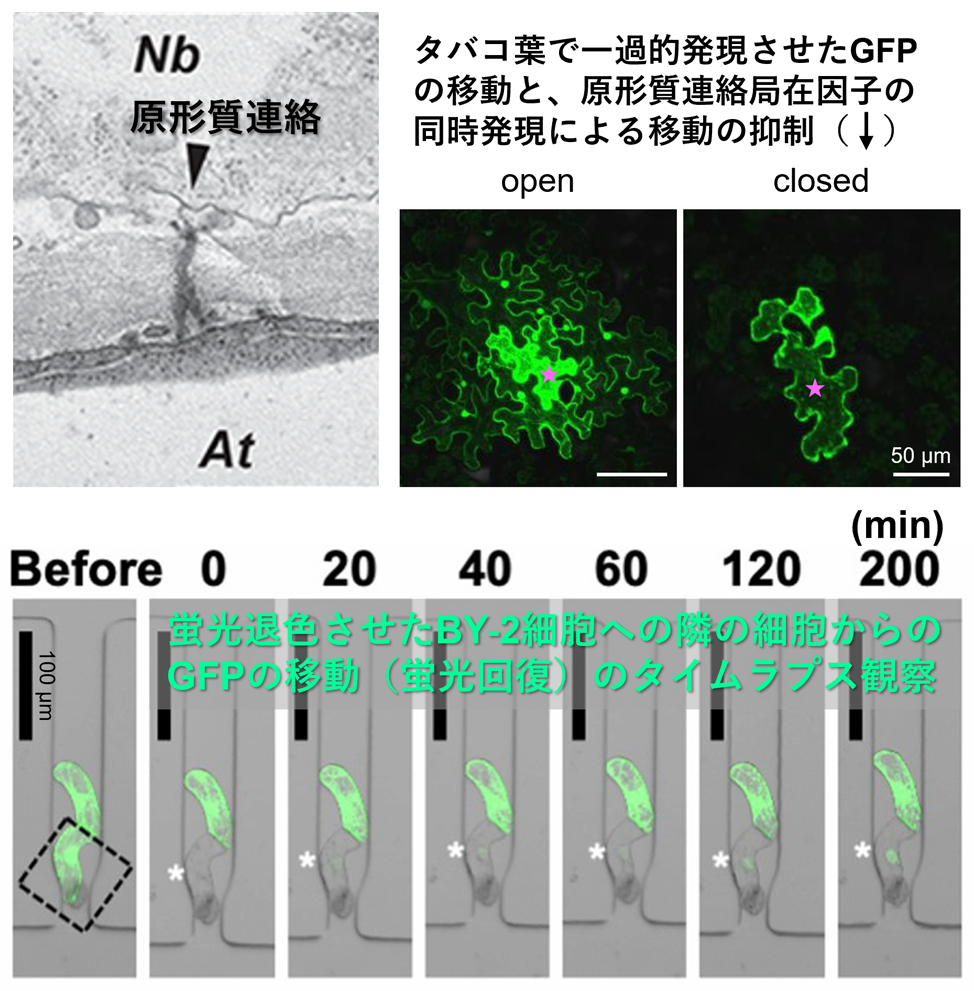
原形質連絡は、構造が非常に微細であることからこれまで解析が困難とされてきました。さらに、植物の個体内では常に原形質連絡の形成と成熟が非同調的に起こっているため、その分子機構の解明もほとんど進んできませんでした。私たちは、異科接木によって2種類の植物に由来する細胞が隣接する接木の境界領域で新たに原形質連絡が形成されることを発見し、その形成過程で発現し、原形質連絡の物質透過性を制御する遺伝子群の同定にも成功しました(図3上)。
原形質連絡の形成や機能の制御メカニズムを詳しく調べるために、タバコ培養細胞(BY-2細胞)をトラップして経時的に観察することを可能にするマイクロデバイスを独自開発しました(PLoS One, 2022; J. Plant Res., 2022; 図3下)。このデバイスを用いて、細胞間の物質輸送を調節する因子の作用を調べ、原形質連絡による物質輸送のメカニズムを解明したいと考えています。
最近の主な発表論文
- Kurotani K, Hirakawa H, Shirasawa K, Tagiri K, Mori M, Ramadan A, Ichihashi Y, Suzuki T, Tanizawa Y, An J, Winefield C, Waterhouse PM, Miura K, Nakamura Y, Isobe S, Notaguchi M. (2024) Establishing a comprehensive web-based analysis platform for Nicotiana benthamiana genome and transcriptome. Plant J.
- Kawakatsu Y, Hara M, Kurotani K, Arima A, Baba Y, Notaguchi M. (2024) A multiplex microfluidic device to detect miRNAs for diagnosis of plant growth status. Hortic. Res. uhae323
- Okada K, Yachi K, Nguyen TAN, Kanno S, Yasuda S, Tadai H, Tateda C, Lee T-H, Nguyen U, Inoue K, Tsuchida N, Ishihara T, Miyashima S, Hiruma K, Miwa K, Maekawa T, Notaguchi M and Saijo Y. (2024) Defense-related callose synthase PMR4 promotes root hair callose deposition and adaptation to phosphate deficiency in Arabidopsis thaliana. Plant J. 120: 2639–2655.
- Notaguchi M, Ichita M, Kawasoe T, Monda K, Kurotani K, Higaki T, Iba K and Hashimoto-Sugimoto M. (2024) PATROL1 functions in both shoot and root biomass increase. Planta 260(5): 105.
- Kawakatsu Y, Okada R, Hara M, Tsutsui H, Yanagisawa N, Higashiyama T, Arima A, Baba Y, Kurotani K, Notaguchi M. (2024) Microfluidic device for simple diagnosis of plant growth condition by detecting miRNAs from filtered plant extracts. Plant Phenomics 6: 0162.
- Kawaguchi K, Notaguchi M, Okayasu K, Sawai Y, Kojima M, Takebayashi Y, Sakakibara H, Otagaki S, Matsumoto S, Shiratake K. (2024) Plant hormone profiling of scion and rootstock cut regions and intra- and interfamily grafted junctions in Nicotiana benthamiana. Plant Signal Behav. 19(1): 2331358.
- Vajjiravel P, Nagarajan D, Pugazhenthi V, Suresh A, Sivalingam MK, Venkat A, Mahapatra PP, Razi K, Murad MA, Bae DW, Notaguchi M, Seth CS, Muneer S. (2024) Circadian-based approach for improving physiological, phytochemical and chloroplast proteome in Spinacia oleracea under salinity stress under light emitting diodes. Plant Physiol. Biochem. 207(1): 108350.
- Seki M, Kuze Y, Zhang X, Kurotani K, Notaguchi M, Nishio H, Suzaki T, Yoshida S, Sugano S, Matsushita T, Suzuki Y. (2023) Development of a method for detecting transcription start sites with high specificity. Nucleic Acids Res. 52(2): e7.
- Yawei L, Shuting W, Adhikari PB, Bing L, Shengjun L, Yue H, Hu G, Notaguchi M, Qiang X. (2023) Evolutionary assessment of SQUAMOSA PROMOTER BINDING PROTEIN-LIKE genes in citrus relatives with specific focus on flowering. Mol. Hortic. 3(1): 13.
- Nakagami S, Notaguchi M, Kondo T, Okamoto S, Ida T, Sato Y, Higashiyama T, Tsai AY, Ishida T, Sawa S. (2023) Root-knot nematode modulates plant CLE3-CLV1 signaling as a long-distance signal for successful infection. Sci. Adv. 9(22): eadf4803.
- Huang C, Kurotani K, Tabata R, Mitsuda N, Sugita R, Tanoi K, Notaguchi M. (2023) Nicotiana benthamiana XYLEM CYSTEINE PROTEASE genes facilitate tracheary element formation in interfamily grafting. Hortic. Res. 10(6): uhad072.
- Ofori PA, Opoku-Agyemang F, Owusu-Nketia S, Amissah N, Notaguchi M. (2023) A New Intercropping System for Cocoa Cultivation Using Erect Cassava. Trop. Agr. Develop. 67: 54-59.
- Kurotani K, Hirakawa H, Shirasawa K, Tanizawa Y, Nakamura Y, Isobe S, Notaguchi M. (2023) Genome sequence and analysis of Nicotiana benthamiana, the model plant for interaction between organisms. Plant Cell Physiol. 64(2): 248-257.
- Saito AN, Maeda AE, Takahara TT, Matsuo H, Nishina M, Ono A, Shiratake K, Notaguchi M, Yanai T, Kinoshita T, Ota E, Fujimoto KJ, Yamaguchi J, Nakamichi N. (2022) Structure–Function Study of a Novel Inhibitor of Cyclin-Dependent Kinase C in Arabidopsis. Plant Cell Physiol. 63(11): 1720-1728.
- Jantean L, Okada K, Kawakatsu Y, Kurotani K, Notaguchi M. (2022) Measurement of reactive oxygen species production by luminol-based assay in Nicotiana benthamiana, Arabidopsis thaliana and Brassica rapa ssp. rapa. Plant Biotechnol. 39(4): 415-420.
- Kurotani K, Kawakatsu Y, Kikkawa M, Tabata R, Kurihara D, Honda H, Shimizu K, Notaguchi M. (2022) Analysis of plasmodesmata permeability using cultured tobacco BY‑2 cells entrapped in microfluidic chips. J. Plant Res. 135(5): 693-701.
- Li Z, Wang L, He J, Li X, Hou N, Guo J, Niu C, Li C, Liu S, Xu J, Xie Y, Zhang D, Shen X, Lu L, Geng D, Chen P, Jiang L, Wang L, Li H, Malnoy M, Deng C, Zou Y, Li C, Zhan X, Dong Y, Notaguchi M, Ma F, Xu Q, Guan Q. (2022) Chromosome-scale reference genome provides insights into the genetic origin and grafting-mediated stress tolerance of Malus prunifolia. Plant Biotech. J. 20(6): 1015-1017.
- Shimizu K, Kawakatsu Y, Kurotani K, Kikkawa M, Tabata R, Kurihara D, Honda H, Notaguchi M. (2022) Development of Microfluidic Chip for Entrapping Tobacco BY-2 Cells. PLoS One 17(4): e0266982.
- Notaguchi M, Pallas V, Qiu J, Wang X. (2022) Editorial: Systemic RNA Signalling in Plants. Front. Plant Sci. 12: 878728.
- Kurotani K, Huang C, Okayasu K, Ichihashi Y, Shirasu K, Suzuki T, Higashiyama T, Niwa M, Notaguchi M. (2022) Discovery of the interfamily grafting capacity of Petunia, a floricultural species. Hortic. Res. 9: uhab056.
- Kurotani K, Notaguchi M. (2021) Cell-to-cell connection in plant grafting – molecular insights into symplasmic reconstruction. Plant Cell Physiol. 62(9): 1362–1371.
- Kawakatsu Y, Sakamoto T, Nakayama H, Kaminoyama K, Igarashi K, Yasugi M, Kudoh H, Nagano JA, Yano K, Kubo N, Notaguchi M, Kimura S. (2021) Combination of genetic analysis and ancient literature survey reveals the divergence of traditional Brassica rapa varieties from Kyoto, Japan. Hortic. Res. 8(1): 132.
- Motomura K, Takeuchi H, Notaguchi M, Tsuchi H, Takeda A, Kinoshita T, Higashiyama T, Maruyama D. (2021) Persistent directional growth capability in Arabidopsis thaliana pollen tubes after nuclear elimination from the apex.Nat. Commun. 12(1): 2331.
- Tsutsui H, Kawakatsu Y, Notaguchi M. (2021) A silicone micrografting chip in Arabidopsis thaliana. Bio protoc. 11(12): e4053.
- Okayasu K, Aoki K, Kurotani K, Notaguchi M. (2021) Tissue adhesion between distant plant species in parasitism and grafting. Commun. Integr. Biol. 14(1): 21-23.
- Kawakatsu Y, Sawai Y, Kurotani K, Shiratake K, Notaguchi M. (2020) An in vitro grafting method to quantify mechanical forces of adhering tissues. Plant Biotechnol. 37(4): 451-458.
- Honma Y, Adhikari PB, Kuwata K, Kagenishi T, Yokawa K, Notaguchi M, Kurotani K, Toda E, Bessho-Uehara K, Liu X, Zhu S, Wu X, Kasahara RD. (2020) High-quality sugar production by osgcs1 rice. Commun. Biol. 3(1): 617.
- Notaguchi M, Kurotani K, Sato Y, Tabata R, Kawakatsu Y, Okayasu K, Sawai Y, Okada R, Asahina M, Ichihashi Y, Shirasu K, Suzuki T, Niwa M, Higashiyama T. (2020) Cell-cell adhesion in plant grafting is facilitated by β-1,4-glucanases. Science 369(6504): 698-702.
- Kurotani K, Wakatake T, Ichihashi Y, Okayasu K, Sawai Y, Ogawa S, Cui S, Suzuki T, Shirasu K, Notaguchi M. (2020) Host-parasite tissue adhesion by a secreted type of β-1,4-glucanase in the parasitic plant Phtheirospermum japonicum. Commun. Biol. 3(1): 407.
- Tsutsui H, Yanagisawa N, Kawakatsu Y, Ikematsu S, Sawai Y, Tabata R, Arata H, Higashiyama T, Notaguchi M. (2020) Micrografting device for testing environmental conditions for grafting and systemic signaling in Arabidopsis. Plant J. 103(2): 918-929.
メンバー
- 野田口 理孝(教授)
- 望月 伸悦(助教)
- 永原 史織(助教)
- 和田 晶子(事務補佐員)
- 岩田 拓巳(修士課程2年)
- 伊藤 功紀(修士課程1年)
- 大山 泰生(修士課程1年)
- 石原 潮人(研究生)
- 梅澤 陽登(学部4年)