形態統御学分科・年報(2024年度)
研究内容の概略
太陽光からエネルギーをえる植物は太陽の動きで生じる昼夜環境変動に対してうまく適応しなければならない。生物時計の一種である概日時計はその適応的な形質の一つとして捉えることができ、生物時計が示す時刻をうまく利用することで植物は変動環境のなかで生き抜いている。当分科では、植物の概日時計システムにおける階層性、時刻情報伝達様式、さらに時計合わせや時計の利用法を対象に、分子、細胞から個体、生態レベルまで多彩な視点から研究を進めている(図1)。さらに、時間の使い方に現れる生き物の多様性・個性についても興味をもって研究を進めている。また、小さいながらも多彩な生理学的側面を見せるウキクサ植物を材料として利用する点と生物発光レポーター系を駆使した実験をする点が当分科の特徴としてあげられる。
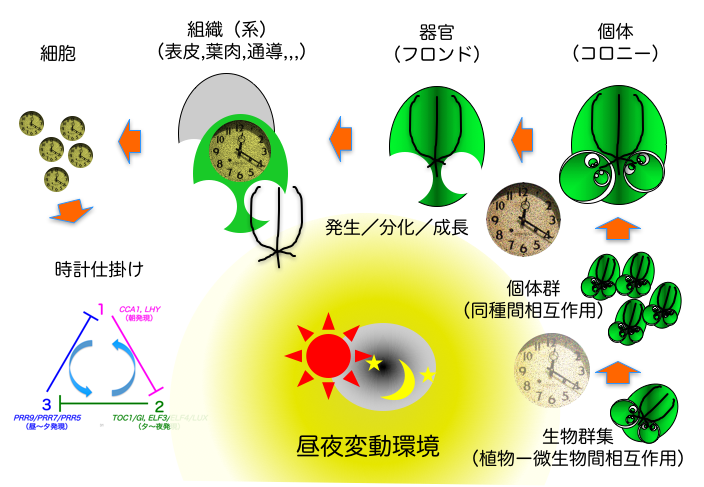
1. 各階層の植物概日時計システムの多様性とその意義
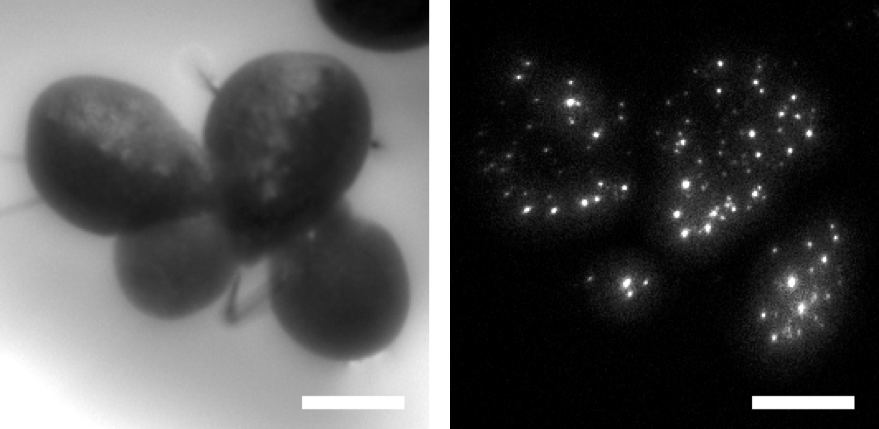
概日時計システムは生物の計時機構を代表する普遍的なシステムであり、植物においても光エネルギー利用の最適化など非常に重要な役割をもっている。その基盤となる概日時計(振動体)は、バクテリア、真菌、動物、植物等でそれぞれ異なった構成因子で形成されているが、どの生物においても細胞単位で発振することが基本となっている。植物細胞は光受容機構を備えるため、昼夜の環境情報をもとに細胞単位で時計の時刻(針)を調節することができると考えられているが、植物個体内では個々の細胞時計は近接細胞間相互作用や長距離時刻情報伝達などを介して時空間的に制御されて働くことが想定されている。当分科では、ウキクサの仲間を材料に個々の細胞時計の動き(つまり細胞概日リズム)の測定および細胞時計の集合体である植物個体(増殖期)の時計の挙動解析に成功した。ウキクサは単子葉類のサトイモ科に属し、個体サイズが小さく扁平で水面に浮いた状態で成長する。この構造的特徴から個体が増殖する状態でも、その主要部分(フロンドあるいは葉状体とよぶ)の上面が常に水平かつ水面からの距離(高さ)が一定になり、植物個体を一定の条件で高解像度に観測し続けることが可能となる。これらの特性を生かして、植物個体内の概日時計システムを単一細胞の遺伝子発現の挙動測定から解析する手法を開発した(図2)。同一個体上でも単一細胞のリズムの性質は細胞間でバラつく他、同一細胞でも恒常条件下でのサイクル毎のバラツキが非常に大きくなることを定量的に示した。さらに、概日発光リズムを示す形質転換ウキクサ(ムラサキコウキクサ:Lemna japonica)を材料に、増殖する植物個体における概日リズムの自律的な秩序形成にアプローチした(図3、Ueno et al. 2022)。位相(時計の時刻)の空間パターンの初期状態を出発点に、細胞時計間の局所的なカップリング(お互いの時刻を揃えようとする作用)がおこることで、それ以降の動的な位相パターンが生じることを明らかにした。さらにカップリングの程度が発生に伴い低下していくことを仮定すれば、発生/成長を伴う様々な概日リズムの秩序形成様式を説明できることを示した。局所的な細胞時計間の相互作用(カップリング)の動態が植物個体内の概日リズムの秩序形成の基本となることを提案している。一方で、細胞間の相互作用のない単離された細胞(概日発光リズムをもつシロイヌナズナ形質転換体由来)の概日リズムを細胞ごとに観測したところ、周期や安定性などの時計の重要性質は葉由来細胞と根由来細胞とでは異なっていた(Nakamura, Oyama 2022)。つまり、細胞時計の基本性質は相互作用によらずに細胞種ごとに決まっていることが分かってきた。また、葉の細胞と根の細胞の大きな違いは光合成能力の有無であり、両細胞の概日リズムの周期に関する温度感受性の違いが、光合成能力の有無によることを示唆している。
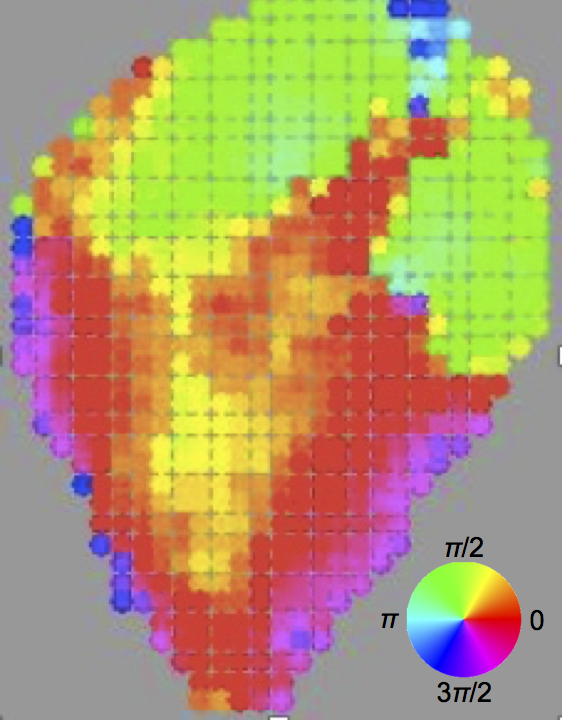
色はその領域が示している概日時計の位相を表している。このフロンドは明暗条件など外部環境変化を一度も受けておらず、自発的に生じた位相パターンであり、時間の経過とともに動的に変化する。
植物個体内で細胞間の時刻情報のやり取りを含む時計の制御機構については、原形質連絡などを介した細胞間の物質のやり取りが重要であると想定されているが、情報を受けた細胞内でのどのような変化が細胞時計に影響をあたえているかについては理解が進んでいない。当分科では、同一細胞内で発光色の異なる2つのレポーター遺伝子を発現させ、それらの発光時系列データを同時に取得できる実験系を確立した(図4、Watanabe et al. 2021)。時計遺伝子CCA1のプロモーター下で発現させたホタルのルシフェラーゼ(LUC: 黄緑色発光)と植物での過剰発現に頻用されるウィルス由来のCaMV35Sプロモーター下で発現させた色改変ルシフェラーゼ(PtRLUC: 橙-赤色発光)を用いた。CaMV35S:LUCの発光が概日リズムを示すことは当分科の研究で明らかになっていた。これらの2つの概日リズムは同一細胞で異なる周期を示すなど発光挙動に違いが見られるのみならず、LUCの細胞発光リズムは細胞時計の動きに追随するが、PtRLUCの細胞発光リズムはその細胞がもつ時計の動きとは独立な挙動を示すことを明らかにした(Watanabe et al. 2023)。一方で、PtRLUCの発光概日リズムは細胞間の物質のやり取りを必要とするが、LUCの発光リズムは独立した細胞でも動き続けることが明らかとなった。さらに、安定性の異なるルシフェラーゼを用いた実験と理論的な研究から、CaMV35Sプロモーター下流のルシフェラーゼ遺伝子が示す発光概日リズムはルシフェラーゼ酵素量の変動で生じておらず、発光効率で生じていることを示した(Horikawa et al. 2024)。発光効率に影響を与える生理学的反応系が組織・個体レベルで同調した概日リズムを持つと考えられ、実際に同一個体内ではPtRLUCの細胞発光リズムがLUCの細胞発光リズムよりお互いに同調して動くことが明らかとなった。つまり、植物個体内では個々の細胞時計の精度は悪くても、どの細胞もお互いに同調した生理学的リズムを作れることが分かり、植物の個体レベルの時間の使い方の一端を明らかにした。
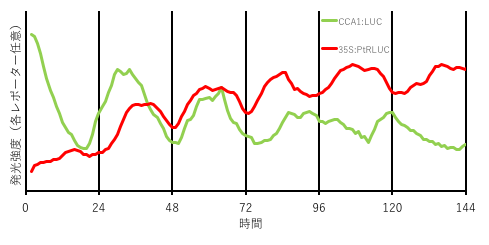
明暗同調を経験したことのないムラサキコウキクサに対して、パーティクルボンバードメント法で2つの発光レポーターを同一細胞に共導入している。発光画像取得時にそれぞれの発光色を透過しやすいフィルタを使用することで、それぞれに由来する発光強度が算出できる。2つのリズムのピーク間隔が時間とともにずれている。
2. ウキクサ植物の多彩な時間の使い方
ウキクサ植物は5属からなり、熱帯から亜寒帯まで世界中の淡水を有する地域に広く分布している。種によっては経度のみならず緯度的にも広く分布するものもある。そのため同種であっても、温度や日長変化に対して多彩な環境適応が生じていると考えられる。当分科では、世界や日本国内の様々な地域で採取され、栄養成長(クローン増殖)で維持されてきたウキクサの仲間を材料に、概日時計の性質や季節変化に応じた成長相転換様式(栄養成長から生殖成長)の多様性に注目し、植物の多彩な時間の使い方の理解を進めてきた。例えば、アオウキクサ属(Lemna属)の植物には春から初夏にかけて開花する長日性の種と夏から秋にかけて開花する短日性の種が両方存在する。イボウキクサ(Lemna gibba)、コウキクサ(Lemna minor)は前者に属し、アオウキクサ(Lemna aequinoctialis)は後者に属する(図5)。アオウキクサは日本の水田で一般的にみられるウキクサであるが、国内各地のアオウキウクサの概日リズムの性質と花成抑制に必要な明期長(限界日長)を調べた結果、緯度が高いところほど周期が短く、限界日長が長くなる(つまり花成しやすい)傾向が明らかとなった(Muranaka et al. 2022)。このような緯度に応じた性質の傾斜(緯度クラインと呼ぶ)は他生物でも知られていたが、内在の概日時計の性質と花成の傾向を同時に調べることにより、周期の多様化が花成時期の多様化に寄与している証拠の一端を示すことができた。内在の概日時計の性質の多様化をより広範囲に調べるために、世界各地のウキクサ(8種のLemna属ウキクサと7種のWolffiella属ウキクサ)の概日リズム特性を観測した結果、Wolffiella属ウキクサのリズムの自律的な概日周期性が低下していることが明らかとなった。この属のウキクサは根や維管束系を退化させており、形態的な単純化と時間制御の単純化が同時に進んでいる可能性が示された。興味深いことに、Wolffiella属のウキクサは主に低緯度地域に分布する一方で、Lemna属のなかでも低緯度に分布するウキクサ種では、自律的な概日周期性が弱まっており、低緯度での時間制御の単純化が一般的に起こる可能性を示した。海洋性シアノバクテリアにおいても、自律的な概日周期性を失ったProchlorococcus類は低緯度にのみ分布することが知られており、概日時計の自律性と生育環境の日長変化の度合いとの関連性が明らかになりつつある。
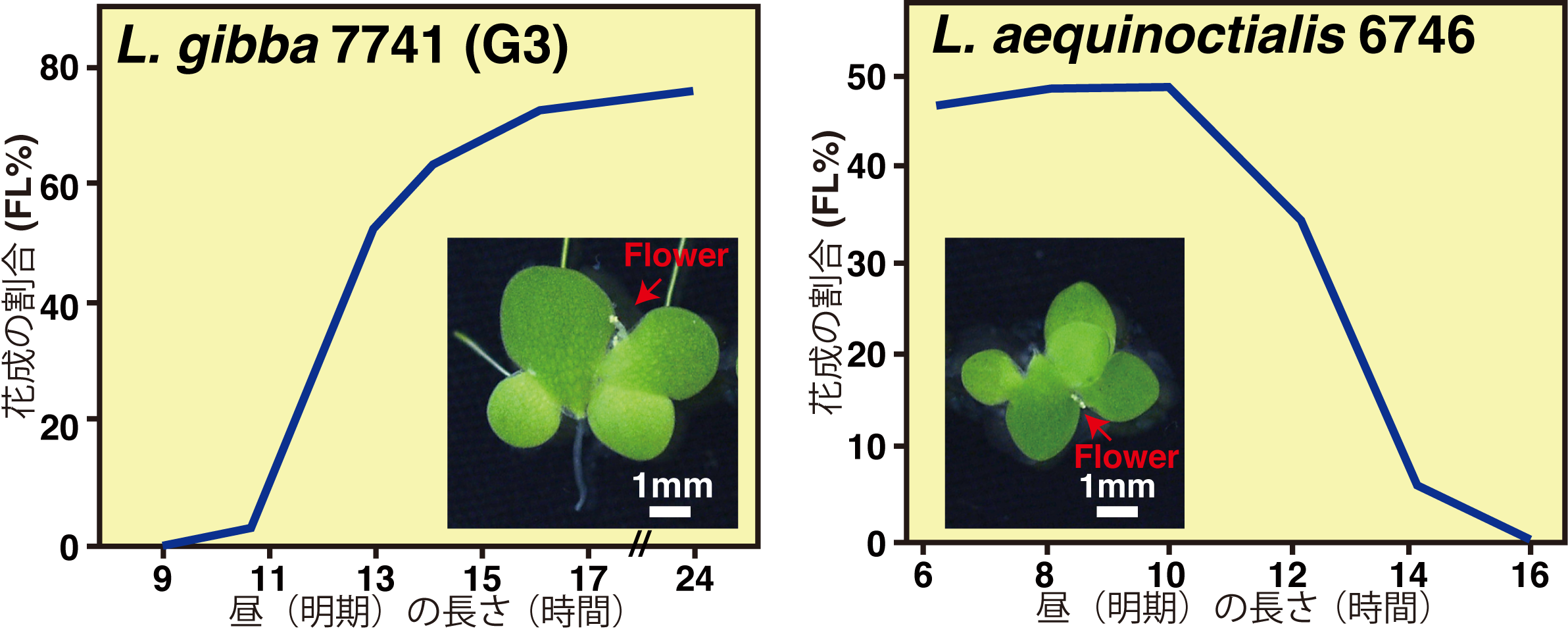
様々な日長条件における長日性イボウキクサ(L. gibba) G3株の花成の割合(左)。24時間周期中の昼(明期)の長さに対して花成率をプロットしてある。様々な日長条件における短日性ナンゴクアオウキクサ(L. aequinoctialis) 6746株の花成の割合(右)。
ウキクサの仲間は冬季や高生育密度・貧栄養などの悪環境期を種子の状態で切り抜ける種があるほか、デンプンを蓄積して水中に沈み休眠するタイプの種も存在する。例えば、キタグニコウキクサ(Lemna turionifera)は生育環境が悪化するとturionと呼ばれる休眠芽を発達させる(図6)。当分科で、高緯度地域に分布するキタグニコウキクサは、短日処理によって休眠を誘導できることを発見した。さらに、休眠の誘導される限界日長、暗期中断の影響、生育温度との関係を明らかにし、休眠芽を用いたRNA-seqによる網羅的発現変動解析を行うことで、光周期依存的な休眠誘導の分子機構の解明を目指している。

長日条件(15時間明期/9時間暗期)で栄養成長している植物(左)と短日条件(9時間明期/15時間暗期)で休眠芽を発達させている植物(右)。スケールバーは5 mm。矢印が発達してきた休眠芽。
3. 研究材料としてのウキクサ植物
ウキクサ植物は基礎研究から生物環境浄化、バイオマス燃料生産、機能性化合物の生産等の植物材料として期待されている。植物のバイオマス生産効率をあげる手法の一つとして、植物の成長を促進するバクテリアの利用が考えられており、それら有用微生物の選抜や応用研究のための植物材料としてウキクサは適している。当分科では、他研究室と共同で選抜法や成長促進の分子機構の解明を進めている(Khairina et al. 2021; Juma et al. 2022)。それらのバクテリアの中には昼夜応答を示すものもあり、植物表面の生態系における時間制御の可能性が示されている。
当分科は、ウキクサ植物の日本におけるストックセンター的な役割を果たしている。現在、5属・32種にわたる約180株の国内外で採取されたウキクサ野生株、形質転換の可能なコウキクサ、キタグニコクイキクサについては約350株の遺伝子組換え体を無菌状態の継代培養によって維持している。維持しているウキクサリストの一部は以下参照(http://cosmos.bot.kyoto-u.ac.jp/clock/research/map_duckweed.html)これらの株の永続的な維持を目的に、大学連携バイオバックアッププロジェクトのサポートのもと、ウキクサ植物の液体窒素による凍結保管(Cryopreservation)技術の開発を進めている(農研機構 遺伝資源研究センター 田中大介博士との共同研究)。この技術は、種子を介さず植物体をそのままの状態で半永久的に保存するものであり、有用株の絶滅を防げるだけでなく、クローン増殖するウキクサにとっては、時代を超えた同一植物の比較を可能にする点でも革新的な意味を持っている。
アメリカのストックセンターRDSCとも連携しながら、様々なウキクサを無菌的に継代培養、または液体窒素下での凍結保存を行っている。
最近の主な発表論文
- Horikawa, Y., Watanabe, E., Ito, S., Oyama, T. (2024) Model-based analysis of the circadian rhythm generation of bioluminescence reporter activity in duckweed. Plant Biotech. in press
- Watanabe, E., Muranaka, T., Nakamura, S., Isoda, M., Horikawa, Y., Aiso, T., Ito, S., Oyama, T. (2023) A non-cell-autonomous circadian rhythm of bioluminescence reporter activities in individual duckweed cells. Plant Physiol. 193, 677-688.
- Muranaka, T., Ito, S., Kudoh, H., Oyama, T. (2022) Circadian-period variation underlies the local adaptation of photoperiodism in the short-day plant Lemna aequinoctialis. iScience 25, 104634.
- Isoda, M., Ito, S., Oyama, T. (2022) Interspecific divergence of circadian properties in duckweed plants. Plant Cell Environ. 45, 1942-1953.
- Nakamura, S., Oyama, T. (2022) Adaptive diversification in the cellular circadian behavior of Arabidopsis leaf- and root-derived cells. Plant Cell Physiol. 63, 421-432.
- Ueno, K., Ito, S., Oyama, T. (2022) An endogenous basis for synchronization characteristics of the circadian rhythm in proliferating Lemna minor plants. New Phytol. 233, 2203-2215.
- Taoka, K.-I., Kawahara, I., Shinya, S., Harada, K.-I., Yamashita, E., Shimatani, Z., Furuita, K., Muranaka, T., Oyama, T., Terada, R., Nakagawa, A., Fujiwara, T., Tsuji, H., Kojima, C. (2022) Multifunctional chemical inhibitors of the florigen activation complex discovered by structure-based high-throughput screening. Plant J. 112, 1337-1349.
- Edelman, M., Appenroth K.J., Sree K.S., Oyama T. (2022) Ethnobotanical history of duckweeds in different civilizations. Plants 11, 2124.
- Juma, P.O., Fujitani, Y., Alessa, O., Oyama, T., Yurimoto, T., Sakai, Y., Tani, A. (2022) Siderophore for lanthanide and iron uptake for methylotrophy and plant growth promotion in Methylobacterium aquaticum strain 22A. Front. Microbiol. 13, 921635.
- Watanabe, E., Isoda, M., Muranaka, T., Ito, S., Oyama, T. Detection of uncoupled circadian rhythms in individual cells of Lemna minor using a dual-color bioluminescence monitoring system. (2021) Plant Cell Physiol. 62, 815-826.
- Yoshida, A., Taoka, K., Hosaka, A., Tanaka, K., Kobayashi, H., Muranaka, T., Toyooka, K., Oyama, T. and Tsuji, H. (2021) haracterization of frond and flower development and identification of FT and FD genes from duckweed Lemna aequinoctialis Nd. Front. Plant Sci. 12, 697206.
- Acosta, K., Appenroth, K.J., Borisjuk, L., Edelman, M., Heinig, U., Jansen, M.A.K., Oyama, T., Pasaribu, B., Schubert, I., Sorrels, S., Sree, K.S., Xu, S., Michael, T.P., Lam, E. (2021) Return of the Lemnaceae: duckweed as a model plant system in the genomics and postgenomics era. Plant Cell 33, 3207-3234.
- Khairina, Y., Jog, R., Boonmak, C., Toyama, T., Oyama, T., Morikawa, M. Indigenous bacteria, an excellent reservoir of functional plant growth promoters for enhancing duckweed biomass yield on site. (2021) Chemosphere 268, 129247
- Muranaka, T., Oyama, T. The application of single cell bioluminescent imaging to monitor circadian rhythms of individual plant cells. (2020) Methods in Mol. Biol.–Bioluminescent Imaging– (Springer Nature), pp 231–242.
- Kanesaka, Y., Okada, M., Ito, S., Oyama T. Monitoring single-cell bioluminescence of Arabidopsis leaves to quantitatively evaluate the efficiency of a transiently introduced CRISPR/Cas9 system targeting the circadian clock gene ELF3. (2019) Plant Biotech. 36, 187–193.
- 村中智明、小山時隆 植物個体内の単一細胞発光モニタリング (2019) 実験医学別冊 『発光イメージング実験ガイド』(永井健治・小澤岳昌編)pp 145–158.
- Okada, M., Muranaka, T., Ito, S., Oyama, T. (2017) Synchrony of plant cellular circadian clocks with heterogeneous properties under light/dark cycles. Sci. Rep. 7, 317.
- Muranaka, T., Oyama, T. (2016) Heterogeneity of cellular circadian clocks in intact plants and its correction under light-dark cycles. Sci. Adv. 2, e1600500.
2024 年度学位論文
修士論文
- 堀川 湧「ルシフェラーゼレポーターを発現させたウキクサ植物の発光概日リズム生成機構の研究」
メンバー
- 小山 時隆(准教授)
- 伊藤 照悟(助教)
- 大坪 真樹(研究補助員)
- 羅 迪(Luo Di)(博士後期課程3年)
- 上野 稜平(博士後期課程3年)
- 相磯 豪志(博士後期課程2年)
- 野崎 友也(博士後期課程2年)
- 堀川 湧(博士後期課程1年)
- 津田 祐伍(修士課程2年)
- 鳥羽 重孝(修士課程2年)
- 本多 翔(修士課程1年)
- 内藤 恒太(修士課程1年)
- 澤崎 凌(学部4回生)
- 伊藤 有希乃(教務補佐員)