植物分子遺伝学・年報(2024年度)
研究内容の概略
1. 光合成電子伝達の調節に関する研究
(1)葉緑体プロトン駆動力制御の研究
光化学系 I サイクリック電子伝達は半世紀以上前に発見されたが、その生理機能は不明であった。シロイヌナズナの変異株の解析から、高等植物では、PGR5タンパク質に依存する経路とNDH複合体に依存する経路が存在し、特にPGR5依存経路は、光合成と葉緑体を過剰な光から守る反応に重要な役割を果たすことが明らかになった(図1)。サイクリック電子伝達は、葉緑体チラコイド膜を介したプロトン駆動力の大きさを調節するが、さらにプロトン駆動力の成分(プロトン濃度勾配と膜電位)を調節する装置や電子伝達のブレーキについて研究を行っている。

野生型(WT)とPGR5経路変異株(pgr5)、NDH経路変異株(crr2-2, crr3, crr4-2)、PGR5経路とNDH経路両方を欠く二重突然変異体(crr2-2 pgr5, crr3 pgr5, crr4-2 pgr5)。
(2) NDH複合体の構造、機能、進化、アセンブリーの解析
NDH複合体はシアノバクテリアに由来し、葉緑体で光化学系 I サイクリック電子伝達を触媒する。私たちは、NDH複合体のサブユニット遺伝子の発現調節および複合体アセンブリーに関する研究を行っている。また陸上植物の進化の過程で、構造と機能の変化の相関を研究している。
2. 葉緑体遺伝子発現調節機構の解明
葉緑体は独自のゲノムを持つオルガネラであるが、その遺伝子発現調節は、核コード遺伝子が行なっている。私たちはクロロフィル蛍光イメージングの手法で、葉緑体遺伝子発現調節が異常な変異株を多数単離、解析してきた。遺伝子発現調節の主役を担うのが配列特異的なRNA結合活性を持つPPRタンパク質である。私たちはPPRタンパク質によるRNA編集、RNA安定化、翻訳制御の分子機構、生理機能の解明を目指して研究を行っている。
トウモロコシなどのC4植物は、細胞によって異なる葉緑体を作ることで、効率の良い光合成を実現している。そのためには、葉緑体遺伝子の組織特異的発現の必要がある。私たちは、その分子機構の解明を目指している。
3. 植物ミトコンドリアや葉緑体のユニークな転写後調節―RNA編集機構
陸上植物のミトコンドリアと葉緑体にはRNAの特定のシチジン(C)をウリジン(U)へと変換するユニークなRNA編集が存在する。この機構は植物に必須であり、オルガネラゲノムコードの遺伝子機能は、この編集を経てはじめて正常に発現する。植物オルガネラのRNA編集因子であるPPRタンパク質の基本構造はN末端側に配列特異的にRNAに結合するPPRドメインをもち、C末端にCをUに変換するDYWデアミナーゼドメインをもつ。私たちはDYWドメインの立体構造解析に世界ではじめて成功した。DYWドメインは他のシチジンデアミナーゼ酵素には存在しないゲーティング(門)ドメインをもち、これがスイッチのように動くことでその活性が制御されることが分かってきた。現在、私たちは、PPRドメインの塩基配列特異性やDYWデアミナーゼ活性を制御する分子機構に加えて、PPRタンパク質を含む多数のタンパク質が形成するRNA編集複合体の分子機構をより包括的に明らかにしたいと考えている。また最近はオルガネラゲノムの任意の位置に変異を導入できる新たな技術を用い、ミトコンドリアや葉緑体の遺伝子発現調節機構のより多角的な理解を目指している。
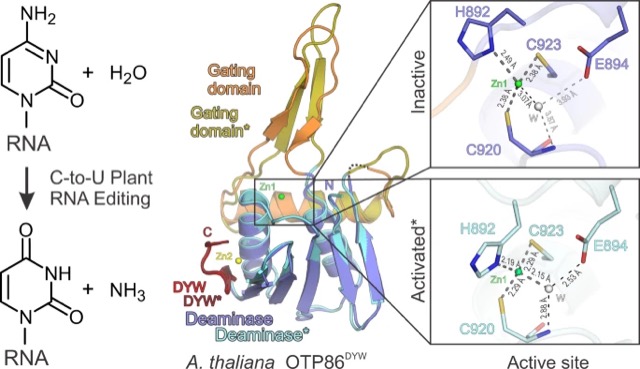
DYWドメインの内部にあるゲーティングドメインがスイッチのように動くことで、亜鉛を含む活性中心の構造が変化し、酵素が活性化される(Nature Catal. 2021より)。
4. 植物幹細胞の分化、増殖を制御する仕組みにせまる
植物の幹細胞とはどういうものなのか?未分化な状態とは何であるのか?幹細胞らしさの獲得や維持、あるいは喪失はどのように制御されているのか?これらは、植物の発生を理解する上で重要な問題であるが、分子レベルでの解明にはほとんど至っていない。植物幹細胞の分化、増殖の制御に関わる遺伝子を単離同定し、解析している。
CUV遺伝子は、パン酵母からヒト、植物に広く保存されているスプライシング因子Prp16オーソログをコードする。CUVが、オーキシン生合成や極性輸送、受容、応答に関わる遺伝子の発現を遺伝子特異的、組織特異的に促すこと、オーキシンを介した根端分裂組織の維持などに関わることを明らかにしている。また、葉脈形成の鍵のひとつがオーキシンの局所的な生合成にあること、オーキシンの生合成場所(オーキシン生合成の鍵酵素の発現場所)はオーキシンの極性輸送によって決められているのではないことを明らかにしている。
NOV遺伝子は、2729アミノ酸からなる新規核タンパク質をコードし、オーキシンを介した細胞分化・器官形成、幹細胞の維持などに関わる。一方、植物幹細胞らしさの抑制に関わる新規遺伝子として、VAHを同定している。VAHは、複数のWOX遺伝子の発現を負に制御し、幹細胞領域の制限に関わる。これまでに、NOVもVAHもエピジェネティック遺伝子発現制御に関わることを明らかにしている。NOVとVAHは幹細胞について真逆と言える役割を持つことから、エピジェネティック遺伝子発現制御についても異なる役割を持つと考え研究を進めている。NOVとVAHを比較しつつ解析することにより、幹細胞らしさの分化制御だけでなく、エピジェネティック遺伝子発現制御の理解も深まると期待している。
最近の主な発表論文
- Frink, B., Burger, M., Yarkoni, M., Shevtsov-Tal, S., Zer, H., Yamaoka, S., Ostersetzer-Biran, O., & Takenaka, M. (2024). PCIS1, encoded by a pentatricopeptide protein co-expressed gene, is required for splicing of three mitochondrial nad transcripts in angiosperms. Plant Cell Physiol. , 65, 1474-1485.
- Kobayashi, R., Yamamoto, H., Ishibashi, K., Shikanai, T. (2024) Critical role of cyclic electron transport around photosystem I in the maintenance of photosystem I activity. Plant J. 118, 2141-2153.
- Shikanai, T. (2024) Molecular genetic dissection of the regulatory network of proton motive force in chloroplasts. Plant Cell Physiol. 65, 537-550.
- Bayer-Császár, E., Jörg, A., Härtel, B., Brennicke, A., Takenaka, M. (2024) The Gating Domain of MEF28 is Essential for Editing Two Contiguous Cytidines in nad2 mRNA in Arabidopsis thaliana. Plant Cell Physiol. 65, 590-601.
- Ogawa, Y., Iwano, M., Shikanai, T., Sakamoto, W. (2023) FZL, a dynamin-like protein localized to curved grana edges, is required for efficient photosynthetic electron transfer in Arabidopsis. Frontiers Plant Science 14, 1279699.
- Yamamoto, H., Cheuk, A., Shearman, J., Nixon, P.J., Meier, T., Shikanai, T. (2023) Impact of engineering the ATP synthase rotor ring on photosynthesis in tobacco chloroplasts. Plant Physiol., 192, 1221-1233.
- Zhou, Q., Yamamoto, H., Shikanai, T. (2023) Distinct contribution of two cyclic electron transport pathways to P700 oxidation. Plant Physiol.192, 326-341.
- Toma-Fukai, S., Sawada, Y., Maeda, A., Shimizu, H., Shikanai, T., Takenaka M., Shimizu, T. (2023) Structural insight into the activation of an Arabidopsis organellar C-to-U RNA editing enzyme by active site complementation. Plant Cell 35,1888-1900
- Maeda A., Takenaka S., Wang T., Frink B., Shikanai T., Takenaka M. (2022) DYW deaminase domain has a distinct preference for neighboring nucleotides of the target RNA editing sites. Plant J. 111, 756-767.
- Basso, L., Sakoda, K., Kobayashi, R., Yamori, W., Shikanai T. (2022) Flavodiiron proteins enhance the rate of CO2 assimilation in Arabidopsis under fluctuating light intensity. Plant Physiol. 189, 375-387.
- Zhou, Q., Wang, C., Yamamoto, H., Shikanai T. (2022) PTOX-dependent safety valve does not oxidize P700 during photosynthetic induction in the Arabidopsis pgr5 mutant. Plant Physiol. 188, 1264-1276.
- Kato, Y., Odahara, M., Shikanai T. (2021) Evolution of an assembly factor-based subunit contributed to a novel NDH-PSI supercomplex formation in chloroplasts. Nat. Commun. 12, 3685.
- Takenaka, M., Takenaka, S., Barthel, T., Frink, B., Haag, S., Verbitskiy, D., Oldenkott, B., Schallenberg-Rüdinger, M., Feiler, C.G., Weiss, M.S., Palm, G.J., Weber, G. (2021) DYW domain structures imply an unusual regulation principle in plant organellar RNA editing catalysis. Nature Catal. 4, 510-522.
- Higashi, H., Kato, Y., Fujita, Y., Iwasaki, S., Nakamura, M., Nishimura, Y., Takenaka, M., Shikanai, T. (2021) The pentatricopeptide repeat protein PGR3 regulates the translation of petL and ndhG by binding their 5’UTRs. Plant Cell Physiol. 62, 1146-1155.
- Yamamoto, H., Sato N., Shikanai, T. (2021) Critical role of NdhA in the incorporation of the peripheral arm into the membrane-embedded part of the chloroplast NADH dehydrogenase-like complex. Plant Cell Physiol. 62,1131-1145.
- Kneuper, I., Teale, W., Dawson, J., Tsugeki, R., Katifori, E., Palme, K., Ditengou, F. A. (2021) Auxin biosynthesis and cellular efflux act together to regulate leaf vein patterning. J. Exp. Bot. , 72, 1151-1165.
- Basso, L., Yamori, W., Szabo, I., Shikanai, T. (2020) Collaboration between NDH and KEA3 allows maximally efficient photosynthesis after a long dark adaptation. Plant Physiol 184, 2078-2090.
- Okegawa, Y., Basso, L, Shikanai T., Motohashi, K. (2020) Cyclic electron transport around photosystem I contributes to photosynthetic induction with Thioredoxin f. Plant Physiol. 184, 1291-1302.
- Yamamoto, H., Shikanai, T. (2020) Does the Arabidopsis proton gradient regulation 5 mutant leak protons from the thylakoid membrane? Plant Physiol. 184, 421-427.
- Small, I., Schallenberg-Rüdinger, M., Takenaka, M., Mireau, H., Ostersetzer-Biran, O. (2020) Plant organellar RNA editing: what 30 years of research has revealed. Plant J., 101,1040-1056.
- Tsugeki, R., Terada, S. (2015) The Arabidopsis ortholog of the DEAH-box ATPase Prp16 influences auxin-mediated development. Plant Signaling Behavior, 10, e1074369.
- Tsugeki, R., Tanaka-Sato, N., Maruyama, N., Terada, S., Kojima, M., Sakakibara, H., Okada, K. (2015) CLUMSY VEIN, the Arabidopsis DEAH-box Prp16 ortholog, is required for auxin-mediated development. Plant J., 81, 183-197.
2024 年度学位論文
博士論文
- Brody Frink「Arabidopsis thalianaにおけるPPRタンパク質関連オルガネラRNAプロセシング」
メンバー
- 鹿内 利治(教授)
- 竹中 瑞樹(准教授)
- 槻木 竜二(助教)
- 東 遥香(特定助教)
- Deborah Schatz-Daas(博士研究員)
- 間宮 章仁(博士研究員)
- 王 騰華(博士後期課程3年)
- 小林 亮平(博士後期課程3年)
- 金澤 晴樹(博士後期課程2年)
- Xie Jingchan(博士後期課程1年)
- Ji Jingxiu(修士課程2年)
- 與那嶺 宝冬(修士課程2年)
- 松本 健弘(修士課程1年)
- 竹中 佐知(技術補佐員)
- 久留 知里(事務補佐員)