植物生理学分科・年報(2023 年度)
研究内容の概略
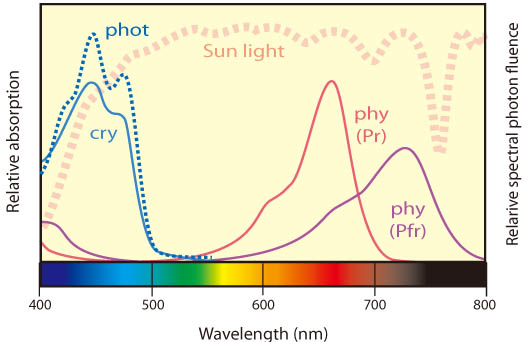
植物は、複数の光受容体(タンパク質)を使い分け、光を貴重な「情報源」として巧みに利用している。当研究室では、フィトクロム(phy)、フォトトロピン(phot)などの光受容体(図1)が様々な生理現象を制御する分子機構について、主にモデル植物であるシロイヌナズナを材料に、分子・細胞レベルの研究を進めている。また、これらの過程に対する葉緑体シグナルの関与についても研究を行っている。さらに、これまで実験室内で明らかにされてきた光応答が、野外の自然環境下でどのように実現されているかに興味をもち、生態学的視点からの研究も開始した。以下、最近の成果を中心に紹介する。
A. 光受容体の構造とシグナル伝達機構
背景
我々は、赤/遠赤色光の受容体であるphyや青色光受容体であるphotoの構造やシグナル伝達機構に関わる研究を長年に渡り進めてきた。最近の成果を中心に以下に紹介する。
1. フォトトロピンの細胞内シグナル伝達機構
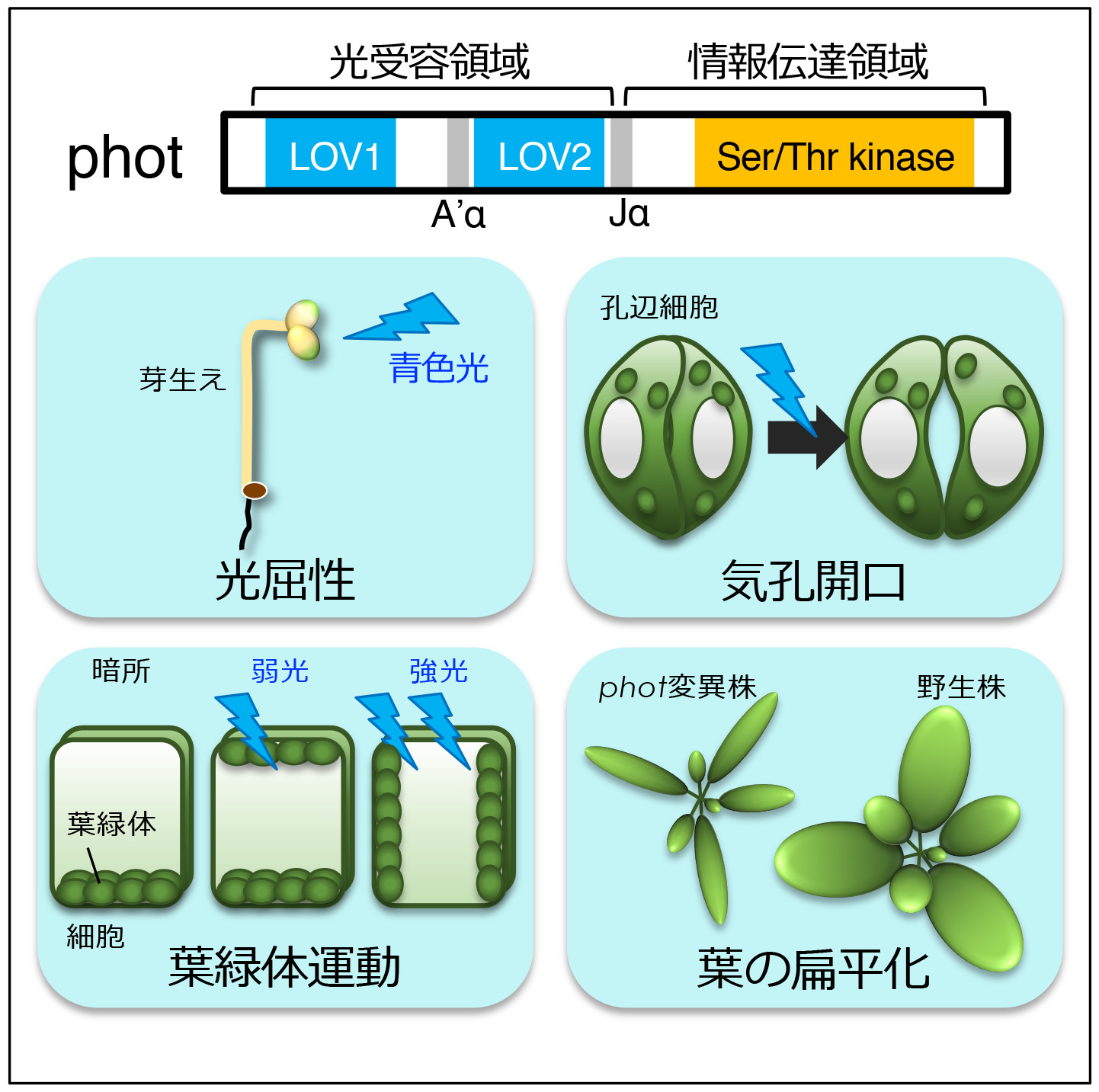
フォトトロピン(phot)は、光合成の効率化と密接に関わる「植物の運動(光屈性・葉緑体定位運動・気孔開口)」を制御する(図2)。我々は、(1)phot情報伝達機構の解明、に加え(2)photを利用した光操作技術の開発も行っています。
(1) phot情報伝達機構の解明
植物は、効率的に光エネルギーを獲得するため巧みに光に応答して細胞・組織・個体レベルで運動している。この運動を光の強度や方向に応じて制御するのが青色光受容体photである。青色光照射後、(a)phot 分子がどこで青色光を受容し、(b)その受容した情報をphot分子内でどのように伝達して、(c)どんな因子に情報伝達するのかを一つずつ明らかにしたいと考えている。
(a) シロイヌナズナ黄化芽生えの光屈性では、胚軸上部約1 mmの範囲内で光受容と屈曲が生じることを生理学的解析によって明らかにし、単子葉植物との比較を行った(Yamamoto et al., 2014)。また、2分子種あるphot(phot1、phot2)のうち、phot2が青色光照射によって速やかに細胞膜からゴルジ体に局在変化することを見出した(Kong et al., 2006)。この局在変化が「植物の運動」においてどのような意味を持つのか明らかにするため解析を進めている。
(b) photの分子内情報伝達様式を明らかにする目的で、ハイスループットな酵母解析系を新たに確立し解析を行った。その結果、暗所でのキナーゼ活性の抑制を行うのに重要な新規領域(A’α領域)の存在を明らかにした(図2)。この研究では、これまで非常に困難であった全長photを高度精製することに世界で初めて成功した(Aihara et al., 2012)。
(c) 独自の解析法にてphot情報伝達に関連する因子の取得に成功した。現在、それら因子の役割と機能について詳細に解析を進めている。
(2) photを利用した光操作技術の開発
生命機能のメカニズム解明のための強力なツールとして、タンパク質等の機能を光で制御する技術が盛んに開発されている。我々は、フォトトロピンを利用して生体膜機能を青色光で制御できる技術の開発を目指している。これまでに、出芽酵母にて脂質輸送体フリッパーゼの活性を光制御するシステムを確立し、膜機能及び細胞の成長方向を青色光にて制御可能であることを報告した(Suzuki et al., 2020)。
2. フィトクロムのシグナル伝達機構
フィトクロム(phy)は、発芽から花芽形成まで植物の生活環の様々な場面で広範囲の生理現象を制御する。暗所から明所への移行に伴う光形態形成、光が遮られた場合に見られる避陰応答などがその典型的な応答である。我々は、フィトクロムA (phyA)分子の特殊機能獲得や、避陰応答の空間構造に関する研究を進めてきた。
phyAの高光感度化
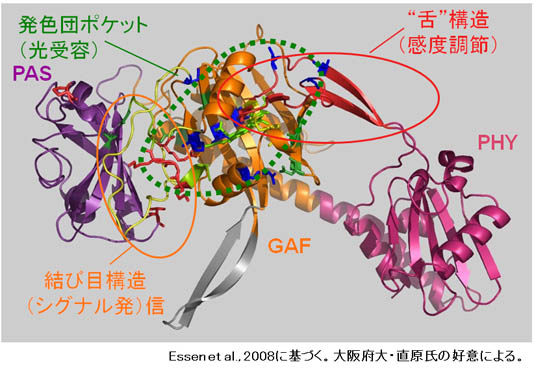
phyAは高光感度受容体として機能し、超低光量応答(VLFR)や遠赤色光高照射反応(FR-HIR)を制御している。我々は、低感度型であるphyBとphyAのキメラタンパク質を植物体で発現させその性質を調べてきた(Oka et al., 2012など)。特に最近では、phy分子内の”舌”構造内にアミノ酸置換変異を導入し(図3)、3つのアミノ酸残基が高光感度化に寄与することを突き止めた。現在、これらのアミノ酸置換とフィトクロム分子の進化の関係について研究を進めている。
B. 個体レベルの光応答における時空間的制御機構の解析
背景
植物の個体レベルの光応答は、組織/器官間シグナル伝達を含む時空間制御システムにより制御されていると考えられる。我々はその実態を明らかにすべく、避陰応答や光刺激によるフック解消を題材に研究を進めている。以下、最近の成果を記す。
避陰応答の空間構造の解析
(1) 微細組織片遺伝子発現解析
陰刺激を与えたシロイヌナズナ芽生えより、維管束を含む領域と含まない領域から微細組織片を採取し、さらに単離維管束試料を加え、発現が上昇する遺伝子をRNA-seq法により網羅的に解析した。その結果、(1)多数の新規避陰応答遺伝子が維管束特異的な応答を示す事、(2)維管束においては、これらに加えて多数のオーキシン応答性遺伝子が応答していることなどが分かった。現在、これらの発現応答の生理学的意義などについて解析を進めている。
(2)微光速照射法による解析
(1)の解析により、オーキシン応答性遺伝子の発現誘導は維管束でより顕著なのに対して、この原因となるオーキシン合成遺伝子の発現誘導は、主に葉肉/表皮組織で特異的に起こることが明らかになった。そこで、微光速照射による局所的な刺激の効果を調べたところ(図4)、維管束におけるオーキシン応答には局所的刺激では不十分で、より広い領域の照射が必要なことが示された。

C. GUNプラスチドシグナルの機能と進化
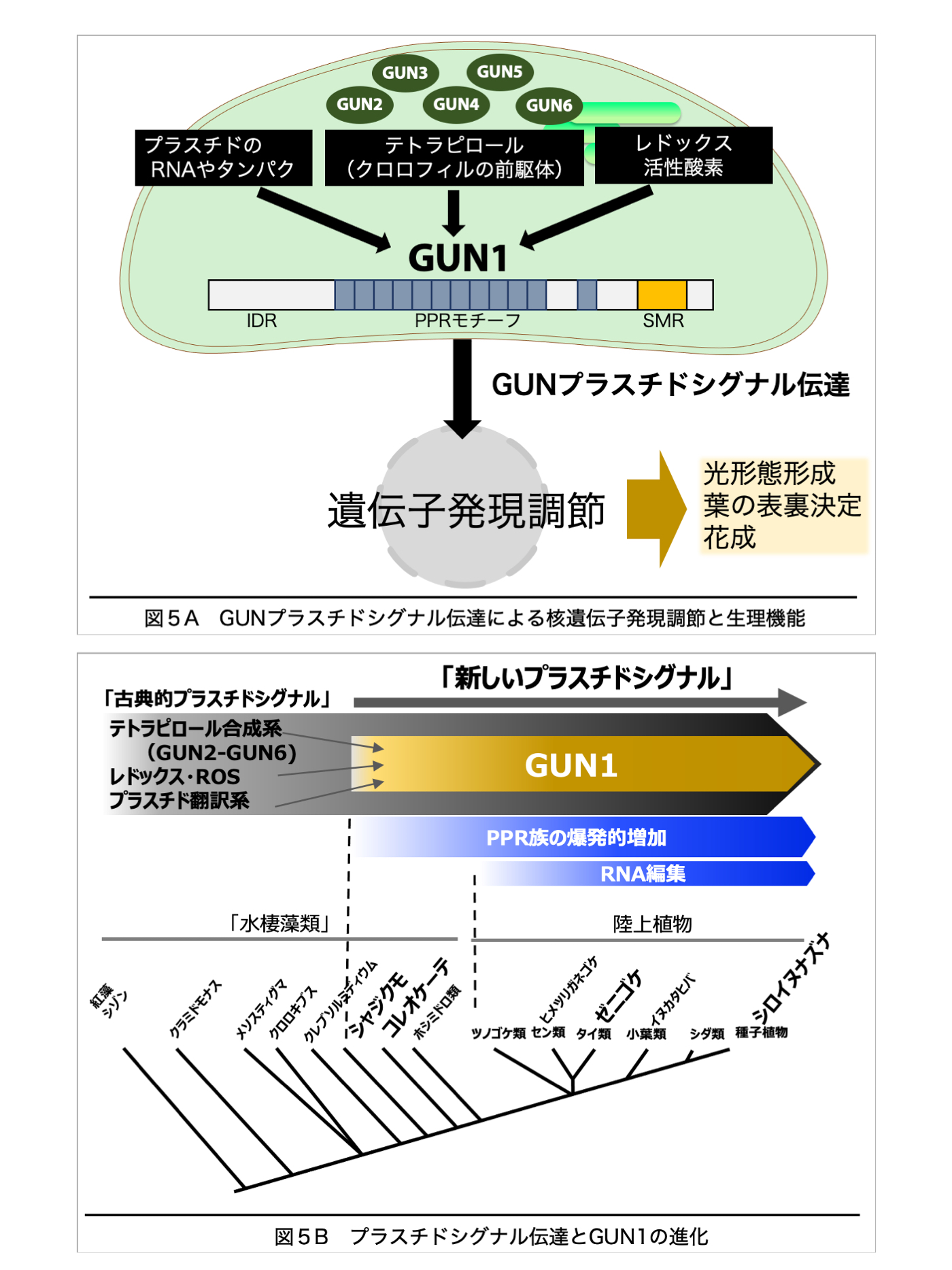
宿主真核細胞に細胞内共生した光合成細菌は、プラスチド(色素体、葉緑体)になる過程で、それ自身の機能や分化状態を細胞核に伝達し、必要な遺伝情報を核ゲノムから効率良く受け取る仕組(プラスチドシグナル)を作り出した。種子植物シロイヌナズナでは、プラスチド内のクロロフィル合成やタンパク質合成、光合成電子伝達系の働きがシグナルとなって、GUN(Genomes Uncoupled)タンパクを介して核に伝わり、遺伝子発現が調節される。これにより、植物はプラスチドを最適な状態に保ち、環境に適応する。本プロジェクトではシロイヌナズナを主な材料として、プラスチドシグナル伝達機構の解明を目指している。
(1)プラスチドシグナルにおいて中心的な役割を果たすGUN(GUN1-GUN6)遺伝子について、シロイヌナズナ突然変異体や過剰発現体を用いた遺伝学的解析や変異体スクリーニングを行い、これまで知られていない経路が見つかった。また、GUN1組換えタンパクを用いて、シグナル伝達の分子機構を調べている。(図5A)。
(2)GUN1はPPR(Pentatricopeptide Repeat)モチーフをもつタンパクであり、他のPPRタンパクと同様に、植物が陸上化する直前、シャジクモ類で出現した。GUN1を持たない紅藻類でもプラスチドシグナルが働いているが、GUN1の出現によってこのシグナル伝達は大きく変化したと考えられる。進化の過程で、GUN1はプラスチド内の多様なタンパクや低分子化合物と特異的に相互作用し、RNA編集にも関わる多機能を獲得した。シャジクモ類や基部陸上植物ゼニゴケ、種子植物のGUN1分子の構造と機能を比較することで、GUN1とプラスチドシグナルの進化、植物の陸上進出の関係を調べている(図5B)。
D. 自然条件下における光応答
背景
植物の光応答を本当の意味で理解するためには、それが形作られ実際に機能する場である自然環境下における実態を知る必要がある。そこで我々は、本学の生態学研究センター・工藤洋教授らの協力を受け、シロイヌナズナと近縁なハクサンハタザオを対象とする野外研究をスタートした(図6)。

1. 自然条件下における光環境測定
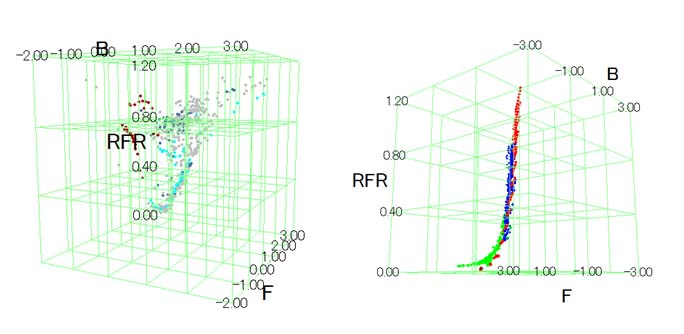
野外において時々刻々と変化する光環境をモニターする手法を確立するため、ハクサンハタザオ生育地で、照度レコーダーや携帯型分光照射照度計などを用い基礎データを収集した。次に、これらをの結果を総合し、ハクサンハタザオが生育する環境において、赤遠赤色光(RFR)、遠赤色光強度(F)、青色光強度(B)などの個々の光受容体と対応したスペクトル成分がどのように変化するかを明らかにした(図7)。
2. ハクサンハタザオの野外採取個体の継代栽培と観察
野外のハクサンハタザオ集団は遺伝的な多様性をもつ。そこで、野外の多数の地点から植物を採取し、それを室内で同一条件で栽培・クローン繁殖した時に、光応答が関わるような形態や生理応答がどの程度異なるかを観察した。その結果、葉柄長や花芽形成のし易さについて、遺伝的と考えられるバリエーションが存在することが分かった。現在、これらの表現型と光環境との関連について解析を進めている。
最近の主な発表論文
- Kawakatsu Y, Okada R, Hara M, Tsutsui H, Yanagisawa N, Higashiyama T, Arima A, Baba Y, Kurotani K, Notaguchi M. (2024) Microfluidic device for simple diagnosis of plant growth condition by detecting miRNAs from filtered plant extracts. Plant Phenomics 6: 0162.
- Kawaguchi K, Notaguchi M, Okayasu K, Sawai Y, Kojima M, Takebayashi Y, Sakakibara H, Otagaki S, Matsumoto S and Shiratake K. (2024) Plant hormone profiling of scion and rootstock cut regions and intra- and interfamily grafted junctions in Nicotiana benthamiana. Plant Signal Behav. 19(1): 2331358.
- Vajjiravel P, Nagarajan D, Pugazhenthi V, Suresh A, Sivalingam MK, Venkat A, Mahapatra PP, Razi K, Murad MA, Bae DW, Notaguchi M, Seth CS, Muneer S. (2024) Circadian-based approach for improving physiological, phytochemical and chloroplast proteome in Spinacia oleracea under salinity stress under light emitting diodes. Plant Physiol. Biochem. 207(1): 108350.
- Seki M, Kuze Y, Zhang X, Kurotani K, Notaguchi M, Nishio H, Takuya Suzaki T, Yoshida S, Sugano S, Matsushita T and Suzuki Y. (2023) Development of a method for detecting transcription start sites with high specificity. Nucleic Acids Res. 52(2): e7.
- Yawei L, Shuting W, Adhikari PB, Bing L, Shengjun L, Yue H, Hu G, Notaguchi M and Qiang X. (2023) Evolutionary assessment of SQUAMOSA PROMOTER BINDING PROTEIN-LIKE genes in citrus relatives with specific focus on flowering. Mol. Hortic. 3(1): 13.
- Nakagami S, Notaguchi M, Kondo T, Okamoto S, Ida T, Sato Y, Higashiyama T, Tsai AY, Ishida T, and Sawa S. (2023) Root-knot nematode modulates plant CLE3-CLV1 signaling as a long-distance signal for successful infection. Sci. Adv. 9(22): eadf4803.
- Huang C, Kurotani K, Tabata R, Mitsuda N, Sugita R, Tanoi K, Notaguchi M. (2023) Nicotiana benthamiana XYLEM CYSTEINE PROTEASE genes facilitate tracheary element formation in interfamily grafting. Hortic Res. 10(6): uhad072.
- Ofori PA, Opoku-Agyemang F, Owusu-Nketia S, Amissah N and Notaguchi M. (2023) A New Intercropping System for Cocoa Cultivation Using Erect Cassava. Tropical Agriculture and Development 67: 54-59.
- Kurotani K, Hirakawa H, Shirasawa K, Tanizawa Y, Nakamura Y, Isobe S, Notaguchi M. (2023) Genome sequence and analysis of Nicotiana benthamiana, the model plant for interaction between organisms. Plant Cell Physiol. 64(2): 248-257.
- Saito AN, Maeda AE, Takahara TT, Matsuo H, Nishina M, Ono A, Shiratake K, Notaguchi M, Yanai T Kinoshita T, Ota E, Fujimoto KJ, Yamaguchi J, Nakamichi N. (2022) Structure–Function Study of a Novel Inhibitor of Cyclin-Dependent Kinase C in Arabidopsis. Plant Cell Physiol. 63(11): 1720-1728.
- Jantean L, Okada K, Kawakatsu Y, Kurotani K, Notaguchi M. (2022) Measurement of reactive oxygen species production by luminol-based assay in Nicotiana benthamiana, Arabidopsis thaliana and Brassica rapa ssp. rapa. Plant Biotechnol. 39(4): 415-420.
- Kurotani K, Kawakatsu Y, Kikkawa M, Tabata R, Kurihara D, Honda H, Shimizu K, Notaguchi M. (2022) Analysis of plasmodesmata permeability using cultured tobacco BY‑2 cells entrapped in microfluidic chips. J. Plant Res. 135(5): 693-701.
- Li Z, Wang L, He J, Li X, Hou N, Guo J, Niu C, Li C, Liu S, Xu J, Xie Y, Zhang D, Shen X, Lu L, Geng D, Chen P, Jiang L, Wang L, Li H, Malnoy M, Deng C, Zou Y, Li C, Zhan X, Dong Y, Notaguchi M, Ma F, Xu Q, Guan Q. (2022) Chromosome-scale reference genome provides insights into the genetic origin and grafting-mediated stress tolerance of Malus prunifolia. Plant Biotech. J. 20(6): 1015-1017.
- Shimizu K, Kawakatsu Y, Kurotani K, Kikkawa M, Tabata R, Kurihara D, Honda H. and Notaguchi M. (2022) Development of Microfluidic Chip for Entrapping Tobacco BY-2 Cells. PLoS One 17(4): e0266982.
- Notaguchi M, Pallas V, Qiu J. and Xutong Wang X. (2022) Editorial: Systemic RNA Signalling in Plants. Front. Plant Sci. 12: 878728.
- Kurotani K, Huang C, Okayasu K, Ichihashi Y, Shirasu K, Suzuki T, Higashiyama T, Niwa M. and Michitaka Notaguchi M. (2022) Discovery of the interfamily grafting capacity of Petunia, a floricultural species. Hortic Res. 9: uhab056.
- Kurotani K and Notaguchi M. (2021) Cell-to-cell connection in plant grafting – molecular insights into symplasmic reconstruction. Plant Cell Physiol. 62(9): 1362–1371.
- Kawakatsu Y, Sakamoto T, Nakayama H, Kaminoyama K, Igarashi K, Yasugi M, Kudoh H, Nagano J A, Yano K, Kubo N, Notaguchi M and Kimura S. (2021) Combination of genetic analysis and ancient literature survey reveals the divergence of traditional Brassica rapa varieties from Kyoto, Japan. Hortic. Res. 8(1): 132.
- Motomura K, Takeuchi H and Notaguchi M, Tsuchi H, Takeda A, Kinoshita T, Higashiyama T, Maruyama D. (2021) Persistent directional growth capability in Arabidopsis thaliana pollen tubes after nuclear elimination from the apex.Nat. Commun. 12(1): 2331.
- Tsutsui H, Kawakatsu Y and Notaguchi M. (2021) A silicone micrografting chip in Arabidopsis thaliana. Bio protoc. 11(12): e4053.
- Okayasu K, Aoki K, Kurotani K, Notaguchi M. (2021) Tissue adhesion between distant plant species in parasitism and grafting. Commun. Integr. Biol. 14(1): 21-23
- Kawakatsu Y, Sawai Y, Kurotani K, Shiratake K, Notaguchi M. (2020) An in vitro grafting method to quantify mechanical forces of adhering tissues. Plant Biotechnol. 37(4): 451-458.
- Honma Y, Adhikari PB, Kuwata K, Kagenishi T, Yokawa K, Notaguchi M, Kurotani K, Toda E, Bessho-Uehara K, Liu X, Zhu S, Wu X, Kasahara RD. (2020) High-quality sugar production by osgcs1 rice. Commun. Biol. 3(1): 617.
- Notaguchi M, Kurotani K, Sato Y, Tabata R, Kawakatsu Y, Okayasu K, Sawai Y, Okada R, Asahina M, Ichihashi Y, Shirasu K, Suzuki T, Niwa M, Higashiyama T. (2020) Cell-cell adhesion in plant grafting is facilitated by β-1,4-glucanases. Science 369(6504): 698-702.
- Kurotani K, Wakatake T, Ichihashi Y, Okayasu K, Sawai Y, Ogawa S, Cui S, Suzuki T, Shirasu K, Notaguchi M. (2020) Host-parasite tissue adhesion by a secreted type of β-1,4-glucanase in the parasitic plant Phtheirospermum japonicum. Commun. Biol. 3(1): 407.
- Tsutsui H, Yanagisawa N, Kawakatsu Y, Ikematsu S, Sawai Y, Tabata R, Arata H, Higashiyama T, Notaguchi M. (2020) Micrografting device for testing environmental conditions for grafting and systemic signaling in Arabidopsis. Plant J. 103(2): 918-929.
メンバー
- 野田口 理孝 (教授)
- 望月 伸悦 (助教)
- 鈴木 友美 (助教)
- 永原 史織 (助教)
- 佐々木 知沙 (事務補佐員)
- 岩田 拓巳(修士課程1年)
- 石原 潮人(学部4年)
- 伊藤 功紀(学部4年)
- 大山 泰生(学部4年)