植物分子遺伝学・年報(2022年度)
研究内容の概略
1. 光合成電子伝達の調節に関する研究
(1)葉緑体プロトン駆動力制御の研究
光化学系 I サイクリック電子伝達は半世紀以上前に発見されたが、その生理機能は不明であった。シロイヌナズナの変異株の解析から、高等植物では、PGR5タンパク質に依存する経路とNDH複合体に依存する経路が存在し、特にPGR5依存経路は、光合成と葉緑体を過剰な光から守る反応に重要な役割を果たすことが明らかになった(図1)。サイクリック電子伝達は、葉緑体チラコイド膜を介したプロトン駆動力の大きさを調節するが、さらにプロトン駆動力の成分(プロトン濃度勾配と膜電位)を調節する装置や電子伝達のブレーキについて研究を行っている。

野生型(WT)とPGR5経路変異株(pgr5)、NDH経路変異株(crr2-2, crr3, crr4-2)、PGR5経路とNDH経路両方を欠く二重突然変異体(crr2-2 pgr5, crr3 pgr5, crr4-2 pgr5)。
(2) NDH複合体の構造、機能、進化、アセンブリーの解析
NDH複合体はシアノバクテリアに由来し、葉緑体で光化学系 I サイクリック電子伝達を触媒する。私たちは、NDH複合体のサブユニット遺伝子の発現調節および複合体アセンブリーに関する研究を行っている。また陸上植物の進化の過程で、構造と機能の変化の相関を研究している。
2. 葉緑体遺伝子発現調節機構の解明
葉緑体は独自のゲノムを持つオルガネラであるが、その遺伝子発現調節は、核コード遺伝子が行なっている。私たちはクロロフィル蛍光イメージングの手法で、葉緑体遺伝子発現調節が異常な変異株を多数単離、解析してきた。遺伝子発現調節の主役を担うのが配列特異的なRNA結合活性を持つPPRタンパク質である。私たちはPPRタンパク質によるRNA編集、RNA安定化、翻訳制御の分子機構、生理機能の解明を目指して研究を行っている。
トウモロコシなどのC4植物は、細胞によって異なる葉緑体を作ることで、効率の良い光合成を実現している。そのためには、葉緑体遺伝子の組織特異的発現の必要がある。私たちは、その分子機構の解明を目指している。
3. 植物ミトコンドリアや葉緑体のRNA編集機構
陸上植物のミトコンドリアと葉緑体にはRNAの特定のシチジン(C)をウリジン(U)へと変換するRNA編集が存在する。オルガネラゲノムにコードされた遺伝子の機能は、この編集を経てはじめて正常に発現する。これまで私たちは植物オルガネラのRNA編集因子として多数のPPRタンパク質を遺伝学的に同定してきた。私たちは、これらのPPRタンパク質の多くがもっているDYWドメインがRNA編集酵素であることを生化学的に示した。また最近、その立体構造の解析に成功した。DYWドメインは他のシチジン脱アミノ化酵素には存在しないゲーティング(門)ドメインをもっていた。このドメインがスイッチのように動くことでその酵素活性が制御されることが分かってきた。現在、私たちは、ゲーティングドメインがどのように制御されDYW編集酵素活性化に寄与するのか、その分子機構を解析している。またMORFなど、他のRNA編集因子の機能やPPRタンパク質との相互作用を解析し、RNA編集複合体の分子機構を明らかにしたいと考えている。
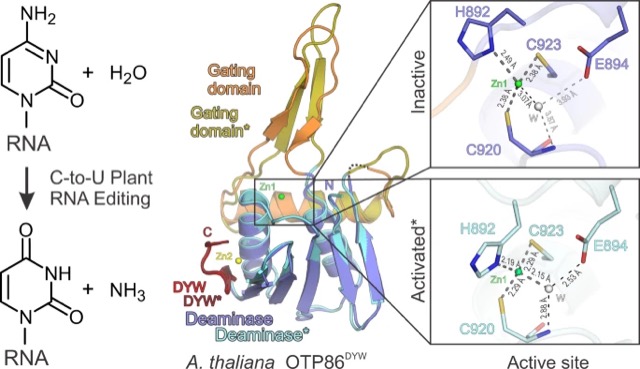
DYWドメインの内部にあるゲーティングドメインがスイッチのように動くことで、亜鉛を含む活性中心の構造が変化し、酵素が活性化される(Nature Catal. 2021より)。
4. 植物幹細胞の分化、増殖を制御する仕組みにせまる
植物の幹細胞とはどういうものなのか?未分化な状態とは何であるのか?分化能の獲得・維持はどのように制御されているのか?これらは、植物の発生を理解する上で重要な問題であるが、分子レベルでの解明にはほとんど至っていない。植物幹細胞の分化、増殖の制御に関わる遺伝子を単離同定し、解析している。
NOV遺伝子は、植物特異的な新規核タンパク質をコードし、オーキシンを介した細胞分化・器官形成、幹細胞維持などに関わる。NOVが遺伝子発現制御に関わることを明らかにしている。CUV遺伝子は、パン酵母からヒト、植物に広く保存されているスプライシング因子Prp16オーソログをコードする。CUVが、オーキシン生合成や極性輸送、受容、応答に関わる遺伝子の発現を遺伝子特異的、組織特異的に促すこと、オーキシンを介した根端分裂組織の維持などに関わることを明らかにしている。また、葉の発生過程でオーキシンの局所的な生合成が葉脈形成の鍵になっていることを発見した。
幹細胞の未分化状態の維持についての研究は多いが、喪失に着目した研究はほとんどない。植物幹細胞の未分化状態の解除に関わる新規遺伝子として、VAHを同定している。VAHは、複数のWOX遺伝子の発現を負に制御する。幹細胞領域の制限に関わる。VAHは、植物の再生過程においても機能することを明らかにしている。VAHについて分子生化学的な解析を始めており、これまでにVAHタンパク質と相互作用するタンパク質因子を同定している。これらから、幹細胞らしさを制御する仕組みの一端を明らかにしたい。
5.葉緑体やミトコンドリアがもつ“染色体”のダイナミズム
葉緑体やミトコンドリアには独自のゲノム「葉緑体/ミトコンドリアゲノム」が存在している。葉緑体/ミトコンドリアゲノムは多様なタンパク質と結合することで「核様体」を形成している。葉緑体/ミトコンドリア核様体は、細胞核における染色体の様に、葉緑体/ミトコンドリアDNAの複製、修復、遺伝子発現、遺伝の機能的中枢であり、光合成や呼吸をはじめとした生命活動の中枢を支えている。
私たちは、これら葉緑体/ミトコンドリア核様体の構造、機能、進化に迫りたいと考えている。
(1)母性遺伝
葉緑体やミトコンドリアDNAは、ヒトを含む多くの生物において母親のみから子孫へと伝えられる。この母性遺伝といわれる現象は、父親由来の葉緑体/ミトコンドリア核様体が受精/接合後に未知の機構によって積極的に破壊されることで引き起こされる。私たちは緑藻クラミドモナスや菌類クリプトコッカスなどをモデルとした遺伝学・細胞学・分子生物学的解析によって、この未知の機構を明らかにしようとしている。
(2)葉緑体核様体の形と機能
葉緑体やミトコンドリア核様体は、細胞周期や植物の発達段階に応じてその形態をダイナミックに変化させる。私たちは核様体の形態制御機構を明らかにすることで、葉緑体/ミトコンドリアゲノムの複製・修復、転写や遺伝の分子機構および進化を理解したいと考えている。
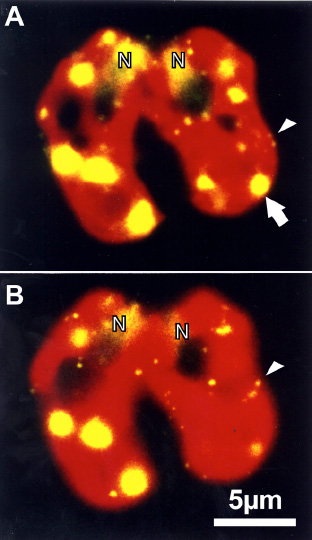
(A, B) SYBR Green Iで接合子のDNAを標識し、経時的に母性遺伝の様子を追った。核(緑色, N)と葉緑体のクロロフィル自家蛍光(赤色)と核様体(黄色)。接合直後(A)は雄雌両方の葉緑体に核様体が存在するが、時間と共に雄由来の葉緑体の核様体が消失している(B)。
最近の主な発表論文
- Yamamoto, H., Cheuk, A., Shearman, J., Nixon, P.J., Meier, T., Shikanai, T. (2023) Impact of engineering the ATP synthase rotor ring on photosynthesis in tobacco chloroplasts. Plant Physiol., in press.
- Zhou, Q., Yamamoto, H., Shikanai, T. (2023) Distinct contribution of two cyclic electron transport pathways to P700 oxidation. Plant Physiol. in press.
- Joo, S.J., Kobayashi, Y., Lee, J-H., Nishimura, Y. (2023) Chapter7: Organelle heredity. The Chlamydomonas sourcebook 3rd ed., Academic Press, Elsevier.
- Toma-Fukai, S., Sawada, Y., Maeda, A., Shimizu, H., Shikanai, T., Takenaka M., Shimizu, T. (2022) Structural insight into the activation of an Arabidopsis organellar C-to-U RNA editing enzyme by active site complementation. Plant Cell in press.
- Maeda A., Takenaka S., Wang T., Frink B., Shikanai T., Takenaka M. (2022) DYW deaminase domain has a distinct preference for neighboring nucleotides of the target RNA editing sites. Plant J.
- Basso, L., Sakoda, K., Kobayashi, R., Yamori, W., Shikanai T. (2022) Flavodiiron proteins enhance the rate of CO2 assimilation in Arabidopsis under fluctuating light intensity. Plant Physiol. 189, 375-387.
- Zhou, Q., Wang, C., Yamamoto, H., Shikanai T. (2022) PTOX-dependent safety valve does not oxidize P700 during photosynthetic induction in the Arabidopsis pgr5 mutant. Plant Physiol. 188, 1264-1276.
- Kato, Y., Odahara, M., Shikanai T. (2021) Evolution of an assembly factor-based subunit contributed to a novel NDH-PSI supercomplex formation in chloroplasts. Nat. Commun. 12, 3685.
- Takenaka, M., Takenaka, S., Barthel, T., Frink, B., Haag, S., Verbitskiy, D., Oldenkott, B., Schallenberg-Rüdinger, M., Feiler, C.G., Weiss, M.S., Palm, G.J., Weber, G. (2021) DYW domain structures imply an unusual regulation principle in plant organellar RNA editing catalysis. Nature Catal. 4, 510–522.
- Higashi, H., Kato, Y., Fujita, Y., Iwasaki, S., Nakamura, M., Nishimura, Y., Takenaka, M., Shikanai, T. (2021) The pentatricopeptide repeat protein PGR3 regulates the translation of petL and ndhG by binding their 5’UTRs. Plant Cell Physiol. 62, 1146-1155.
- Yamamoto, H., Sato N., Shikanai, T. (2021) Critical role of NdhA in the incorporation of the peripheral arm into the membrane-embedded part of the chloroplast NADH dehydrogenase-like complex. Plant Cell Physiol. 62,1131-1145.
- Takusagawa, M., Kobayashi, Y., Fukao, Y., Hidaka, K., Endo, M., Sugiyama, H., Hamaji, T., Kato, Y., Miyakawa, I., Misumi, O., Shikanai, T., Nishimura, Y. (2021) HBD1 protein with a tandem repeat of two HMG box domains is a DNA clip to organize chloroplast nucleoids in Chlamydomonas reinhardtii. Proc. Natl. Acad. Sci. USA, 118, e2021053118.
- Kneuper, I., Teale, W., Dawson, J., Tsugeki, R., Katifori, E., Palme, K., Ditengou, F. A. (2021) Auxin biosynthesis and cellular efflux act together to regulate leaf vein patterning. J. Exp. Bot., 72, 1151-1165.
- Basso, L., Yamori, W., Szabo, I., Shikanai, T. (2020) Collaboration between NDH and KEA3 allows maximally efficient photosynthesis after a long dark adaptation. Plant Physiol 184, 2078–2090.
- Okegawa, Y., Basso, L, Shikanai T., Motohashi, K. (2020) Cyclic electron transport around photosystem I contributes to photosynthetic induction with Thioredoxin f. Plant Physiol. 184, 1291–1302.
- Yamamoto, H., Shikanai, T. (2020) Does the Arabidopsis proton gradient regulation 5 mutant leak protons from the thylakoid membrane? Plant Physiol 184, 421–427.
- Nishimura, Y., Shikanai, T., Kawamoto, S., Toh-e, A. (2020) Step-wise elimination of α-mitochondrial nucleoids and mitochondrial structure as a basis for the strict uniparental inheritance in Cryptococcus neoformans. Sci Rep 10, 2468.
- Small, I., Schallenberg-Rüdinger, M., Takenaka, M., Mireau, H., Ostersetzer-Biran, O. (2020) Plant organellar RNA editing: what 30 years of research has revealed. Plant J. 101,1040–1056.
- Wang, C., Shikanai, T. (2019) Modification of activity of the thylakoid H+/K+ antiporter KEA3 disturbs ∆pH-dependent regulation of photosynthesis. Plant Physiol 181, 762-773.
- Ishibashi, K., Small, I., Shikanai, T. (2019) Evolutionary model of plastidial RNA editing in angiosperms presumed from genome-wide analysis of Amborella trichopoda. Plant Cell Physiol. 60, 2141-2151.
- Mermod, M., Takusagawa, M., Kurata, T., Kamiya, T, Fujiwara, T., Shikanai, T. (2019) SQUAMOSA promoter-binding protein-like 7 mediates copper deficiency response in the presence of high nitrogen in Arabidopsis thaliana. Plant Cell Rep 38, 835-846.
- Nakano, H., Yamamoto, H., Shikanai, T. (2019) Contribution of NDH-dependent cyclic electron transport around photosystem I to the generation of proton motive force in the weak mutant allele of pgr5. Biochim. Biophys. Acta-Bioenerg. 1860, 369-374.
- Yamamoto, H., Shikanai, T. (2019) PGR5-dependent cyclic electron flow protects PSI under fluctuating light at donor and acceptor sides. Plant Physiol. 179, 588-600.
- Kato, Y., Odahara, M., Fukao, Y., Shikanai, T. (2018) Stepwise evolution of supercomplex formation with photosystem I is required for stabilization of chloroplast NADH dehydrogenase-like complex: Lhca5-dependent supercomplex formation in Physcomitrella patens. Plant J. 96, 937-948.
- Wang, C., Takahashi, H., Shikanai, T. (2018) PROTON GRADIENT REGULATION 5 contributes to ferredoxin-dependent cyclic phosphorylation in ruptured chloroplasts. Biochim. Biophys. Acta-Bioenerg. 1859, 1173-1179.
- Kamimura, Y., Tanaka, H., Kobayashi, Y., Shikanai, T., Nishimura, Y. (2018) Chloroplast nucleoids as a transformable network revealed by live-imaging with a microfluidic device. Communications Biology 1, 47.
- Araki, R., Mermod, M., Yamasaki, H., Kamiya, T., Fujiwara, T., Shikanai, T. (2018) SPL7 locally regulates copper-homeostasis-related genes in Arabidopsis. J. Plant Physiol. 224-225, 137-143.
- Otani, T., Kato, Y., Shikanai, T. (2018) Specific substitutions of light-harvesting complex I proteins associated with photosystem I are required for supercomplex formation with chloroplast NADH dehydrogenase-like complex. Plant J. 94, 122-130.
- Kato, Y., Sugimoto, K., Shikanai, T. (2018) NDH-PSI supercomplex assembly precedes full assembly of the NDH complex in chloroplast. Plant Physiol. 176, 1728-1738.
- Kobayashi, Y., Misumi, O., Odahara, M., Ishibashi, K., Hirono, M., Hidaka, K., Endo, M., Sugiyama, H., Iwasaki, H., Kuroiwa, T., Shikanai, T., Nishimura, Y. (2017) Holliday junction resolvases mediate chloroplast nucleoid segregation. Science 356, 631-634.
- Otani, T., Yamamoto, H., Shikanai, T. (2017) Stromal loop of Lhca6 is responsible for the linker function required for the NDH-PSI supercomplex formation. Plant Cell Physiol.58, 851-861.
- Wang, C., Yamamoto, H., Narumiya, F., Munekage, Y.N., Finazzi, G., Szabo, I., Shikanai, T. (2017) Fine-tuned regulation of the K+/H+ antiporter KEA3 is required to optimize photosynthesis during induction. Plant J., 89, 540-553.
- Shikanai, T., Yamamoto, H. (2017) Contribution of cyclic and pseudo-cyclic electron transport to the formation of proton motive force in chloroplasts. Mol. Plant, 10, 20-29.
- Bayer-Császár E., Haag, S., Jörg A., Glass F., Härtel, B., Obata, T., Meyer, E. H., Brennicke, A., Takenaka, M. (2017) The conserved domain in MORF proteins has distinct affinities to the PPR and E elements in PPR RNA editing factors, BBA Gene Regul. Mech., 1860, 813-828.
- Haag, S., Schindler, M., Berndt, L., Brennicke, A., Takenaka, M., Weber, G. (2017) Crystal structures of the Arabidopsis organellar RNA editing factors MORF1 and MORF9. Nucleic Acids Res. , 45, 4915–4928.
- Odahara, M., Kobayashi, Y., Shikanai T., Nishimura, Y. (2016) Dynamic interplay between nucleoid segregation and genome integrity in Chlamydomonas chloroplasts. Plant Physiol., 172, 2337-2346.
- Kobayashi, Y., Takusagawa, M., Harada, N., Fukao, Y., Yamaoka, S., Kohchi, T., Hori, K., Ohta, H., Shikanai, T., Nishimura Y. (2016) Eukaryotic components remodeled chloroplast nucleoid organization during the green plant evolution. Genome Biol. Evol., 8, 1-16.
- Tsugeki, R., Terada, S. (2015) The Arabidopsis ortholog of the DEAH-box ATPase Prp16 influences auxin-mediated development. Plant Signaling Behavior, 10, e1074369.
- Tsugeki, R., Tanaka-Sato, N., Maruyama, N., Terada, S., Kojima, M., Sakakibara, H., Okada, K. (2015) CLUMSY VEIN, the Arabidopsis DEAH-box Prp16 ortholog, is required for auxin-mediated development. Plant J., 81, 183-197.
111, 756-767.
2022 年度学位論文
修士論文
- 小原 一成「母性遺伝の制御機構の解析」
- 小林 亮平「ゲノム編集技術を用いた陸上植物の変動光ストレスへの適応戦略の究明」
メンバー
- 鹿内 利治(教授)
- 竹中 瑞樹(准教授)
- 槻木 竜二(助教)
- 西村 芳樹(助教)
- 田草川 真理(博士研究員)
- 黄 超(博士研究員)
- Deborah Schatz-Daas(博士研究員)
- Brody Frink(博士課程3年)
- 王 騰華(博士課程3年)
- 小林 亮平(博士課程1年)
- 翁 梓玲(修士課程2年)
- 金澤 晴樹(修士課程2年)
- 川島 愛音(修士課程2年)
- 奥井 想大(修士課程1年)
- 與那嶺 宝冬(4回生)
- 竹中 佐知(技術補佐員)
- 得津 縁(技術補佐員)